O benzeno é um composto orgânico aromático que desempenha um papel fundamental na química e na indústria. Sua descoberta remonta ao século XIX, quando foi isolado pela primeira vez a partir de óleos de alcatrão de carvão. Sua estrutura molecular, composta por um anel de seis átomos de carbono ligados alternadamente a átomos de hidrogênio, foi elucidada por volta de 1865 por August Kekulé.
O benzeno possui propriedades físicas e químicas únicas, sendo um líquido incolor inflamável com um odor característico. Devido à sua estabilidade, é amplamente utilizado como solvente em diversas indústrias, além de ser um precursor importante na síntese de muitos compostos orgânicos.
Dentre os derivados do benzeno, destacam-se compostos como o tolueno, o fenol e o anilina, que são utilizados na produção de plásticos, resinas, medicamentos, entre outros produtos. Apesar de sua importância na indústria, o benzeno é considerado um composto altamente tóxico e cancerígeno, sendo necessário adotar medidas de segurança rigorosas em seu manuseio.
Em resumo, o benzeno é um composto químico essencial com uma longa história e uma ampla gama de aplicações na indústria moderna. Seus derivados desempenham um papel crucial na produção de diversos produtos do nosso cotidiano.
Descubra a composição molecular do benzeno em uma explicação simples e clara.
O benzeno é um composto orgânico que consiste em uma estrutura de anel hexagonal contendo seis átomos de carbono e seis átomos de hidrogênio. Sua fórmula molecular é C6H6. A molécula de benzeno é planar e possui ligações duplas alternadas, o que confere a ela propriedades únicas.
Historicamente, o benzeno foi descoberto por Michael Faraday em 1825. Sua estrutura foi elucidada por volta de 1865 por Kekulé, que propôs a teoria do anel hexagonal de carbono. Essa descoberta revolucionou a química orgânica e abriu caminho para o estudo de compostos aromáticos.
O benzeno é um líquido incolor altamente inflamável, com um odor característico adocicado. É amplamente utilizado na indústria química como solvente e matéria-prima para a síntese de diversos compostos. Além disso, o benzeno é um dos precursores na produção de plásticos, borrachas e medicamentos.
Os derivados do benzeno incluem compostos como o tolueno, o fenol e o anilina, que possuem aplicações em diferentes setores industriais. Esses compostos apresentam propriedades únicas devido à estrutura do benzeno, tornando-os importantes na fabricação de diversos produtos.
Em resumo, o benzeno é uma molécula composta por um anel hexagonal de carbono e hidrogênio, com ligações duplas alternadas. Sua estrutura única e propriedades químicas versáteis o tornam essencial em diversas aplicações industriais.
Derivados do benzeno: conheça as variações químicas desta substância fundamental.
O benzeno é um composto orgânico aromático, que possui uma estrutura cíclica de seis átomos de carbono ligados alternadamente a átomos de hidrogênio. Descoberto no século XIX, o benzeno é uma substância fundamental na química orgânica, sendo amplamente utilizado na indústria química para a produção de uma variedade de compostos.
Os derivados do benzeno são compostos que possuem o anel de benzeno como base, mas com substituições em sua estrutura molecular. Essas substituições podem ocorrer em diferentes posições do anel, resultando em uma ampla gama de compostos com propriedades e usos distintos.
Alguns dos principais derivados do benzeno incluem o tolueno, o fenol, o anilina e os xilenos. Cada um desses compostos possui características únicas que os tornam úteis em diversas aplicações industriais e comerciais.
O tolueno, por exemplo, é amplamente utilizado como solvente em tintas, vernizes e adesivos. Já o fenol é empregado na fabricação de plásticos, resinas e medicamentos. A anilina, por sua vez, é fundamental na produção de corantes e produtos químicos. Os xilenos são utilizados na fabricação de polímeros e na indústria de perfumes.
Em resumo, os derivados do benzeno desempenham um papel crucial na indústria química, fornecendo materiais essenciais para diversos setores da economia. Conhecer as variações químicas desta substância fundamental é fundamental para compreender a diversidade de compostos orgânicos disponíveis no mercado.
Aplicações do benzeno na indústria química, farmacêutica e de combustíveis.
O benzeno é um composto orgânico aromático que possui uma história rica e uma variedade de aplicações na indústria química, farmacêutica e de combustíveis. Sua estrutura molecular consiste em um anel de seis átomos de carbono ligados a hidrogênio, formando uma estrutura cíclica altamente estável.
As propriedades do benzeno, como sua alta estabilidade e reatividade, tornam-no um componente essencial em diversas indústrias. Na indústria química, o benzeno é utilizado na produção de uma variedade de produtos, como plásticos, resinas, borrachas e solventes. Sua capacidade de reagir com outros compostos orgânicos o torna uma matéria-prima valiosa para a síntese de compostos químicos complexos.
Na indústria farmacêutica, o benzeno é utilizado na fabricação de medicamentos, corantes e aromatizantes. Sua estrutura aromática confere propriedades únicas aos compostos derivados do benzeno, tornando-os essenciais para a produção de uma ampla gama de produtos farmacêuticos.
Na indústria de combustíveis, o benzeno é utilizado como aditivo na gasolina, melhorando suas propriedades de octanagem e aumentando a eficiência dos motores. No entanto, o uso do benzeno como aditivo tem sido cada vez mais regulamentado devido aos seus efeitos adversos à saúde humana e ao meio ambiente.
Em resumo, o benzeno desempenha um papel crucial em diversas indústrias, graças às suas propriedades únicas e à sua versatilidade como matéria-prima. Seus derivados são essenciais para a produção de uma ampla variedade de produtos químicos, farmacêuticos e de combustíveis, tornando-o um componente fundamental da economia global.
Usos e aplicações do benzeno na indústria química e na produção de diversos produtos.
O benzeno é um composto orgânico amplamente utilizado na indústria química e na produção de diversos produtos. Sua versatilidade e propriedades únicas o tornam uma substância essencial em muitos processos industriais.
Na indústria química, o benzeno é utilizado como matéria-prima na fabricação de diversos produtos, como plásticos, borrachas, tintas, solventes e pesticidas. Sua estrutura química simples e reatividade fazem dele um componente chave em muitas reações químicas.
Além disso, o benzeno é utilizado na produção de derivados como o tolueno, o fenol e o estireno, que por sua vez são utilizados na fabricação de polímeros, resinas e fibras sintéticas. Esses produtos têm uma ampla gama de aplicações, desde embalagens e revestimentos até materiais de construção e produtos eletrônicos.
Devido às suas propriedades como solvente, o benzeno também é utilizado na indústria de tintas e vernizes, na limpeza de peças metálicas e na extração de óleos essenciais de plantas. Sua capacidade de dissolver uma variedade de substâncias o torna uma escolha popular em muitos processos industriais.
Em resumo, o benzeno desempenha um papel fundamental na indústria química e na produção de diversos produtos essenciais para o nosso dia a dia. Sua versatilidade e aplicações abrangentes o tornam um componente indispensável em muitos setores da economia.
Benzeno: história, estrutura, propriedades, derivados, usos
O benzeno é um composto orgânico constituído por um dos mais simples de todos os hidrocarbonetos aromáticos. Sua fórmula química é C 6 H 6 , da qual se sabe que a razão entre carbono e hidrogênio é igual a 1; isto é, para todo carbono existe um hidrogênio ligado a ele.
Embora sua aparência física seja a de um líquido incolor, é naturalmente encontrado no petróleo e nos produtos dele derivados. Seu cheiro é muito característico, pois lembra uma mistura de cola, betume e gasolina; por outro lado, é um líquido volátil e inflamável.

A imagem acima mostra um recipiente ou frasco com benzeno, presumivelmente de pureza não analítica. Se descobertos, imediatamente os vapores de benzeno se espalhariam por todo o laboratório. Por esse motivo, esse líquido, comumente usado como um solvente simples, é manuseado dentro de um exaustor.
Sendo sua fórmula C 6 H 6 , os químicos do século XIX criaram inúmeras estruturas possíveis que correspondiam a essa razão C / H igual a 1. Não apenas isso, mas a molécula de benzeno deve ter ligações especiais de maneira que possam ser explicadas sua estabilidade incomum contra as reações de adição; típico para alcenos e polienos.
Foi assim que suas ligações representaram um enigma para os químicos da época; até a propriedade chamada aromaticidade ser introduzida . Anteriormente considerado um hexaciclotrieno (com três ligações C = C), o benzeno é muito mais do que isso e é outro dos muitos exemplos de sinergia na química.
Na química orgânica, o benzeno é um símbolo clássico, base estrutural para múltiplos compostos poliaromáticos. A partir de seu hexágono, derivadas infinitas são obtidas por substituição eletrofílica aromática; um anel cujas bordas a estrutura que define novos compostos é plotada.
De fato, seus derivados são devidos aos vastos usos industriais para quem precisa de benzeno entre suas matérias-primas. Desde a preparação de adesivos e fibras têxteis, até plásticos, borrachas, pigmentos, drogas e explosivos. Por outro lado, naturalmente, o benzeno é encontrado em vulcões, incêndios florestais, gasolina e fumaça de cigarro.
História
Descoberta e nomes
Sua descoberta remonta a 1825, normalmente concedida a Michael Faraday, quando ele coletava e experimentava um produto remanescente do gás usado para iluminação. Esse líquido continha uma relação C / H próxima de 1, razão pela qual ele chamou de ‘hidrogênio carbonatado’.
O químico Auguste Laurent nomeou o estranho hidrocarboneto ‘pheno’, derivado da palavra grega ‘ phaínein ‘, que significa brilhante (porque foi obtido após a queima do gás). No entanto, esse nome não foi aceito pela comunidade científica e prevaleceu apenas como ‘fenil’, para se referir ao radical derivado do benzeno.
A partir da goma de benjoim, o químico Eilhard Mitscherlich, nove anos depois, conseguiu produzir o mesmo composto; havia, portanto, outra fonte para o mesmo hidrocarboneto, que ele chamou de ‘benzina’. No entanto, eles também não consideraram o nome apropriado para assumir que era um alcalóide, como o quinino.
Assim, eles substituíram o nome ‘benzina’ por ‘benzol’. No entanto, houve novamente contradições e discrepâncias porque o termo ‘benzol’ confundiu o hidrocarboneto de um álcool. Foi então que nasceu o nome ‘benzeno’, usado pela primeira vez na França e na Inglaterra.
Produção industrial
Nem o gás de iluminação nem a goma de benjoim foram fontes apropriadas para gerar benzeno em larga escala. Charles Mansfield, trabalhando com August Wilhelm von Hofmann, conseguiu isolar o benzeno (vinte anos após sua descoberta) em 1845 do alcatrão de carvão, um produto secundário da produção de coque.
Foi assim que a produção industrial de benzeno a partir do alcatrão de carvão começou. A disponibilidade de benzeno em grandes quantidades facilitou o estudo de suas propriedades químicas e permitiu que este estivesse relacionado a outros compostos de reatividades semelhantes. O próprio August Wilhelm von Hofmann cunhou a palavra “aromático” para benzeno e compostos relacionados.
Estruturas históricas
O sonho de August Kekulé
Friedrich August Kekulé recebe a estrutura hexagonal e cíclica do benzeno por volta de 1865, decorrente de um sonho estranho com Uroboros, a cobra que morde sua própria cauda desenhando um círculo. Assim, ele acreditava que o benzeno poderia ser considerado como um anel hexagonal, e outros produtos químicos geravam estruturas possíveis, que são mostradas abaixo:

Algumas das estruturas superiores poderiam justificar a estabilidade do benzeno.
Livro, anéis e prisma
Note que a terceira estrutura não é nem um anel, mas um prisma triangular, proposto por Albert Ladenburg em 1869; à esquerda, um na forma de um livro aberto, proposto por Sir James Dewar em 1867; e à direita, um com todo o hidrogênio direcionado para o centro do anel, proposto por Henry Edward Armstrong em 1887.
A primeira estrutura, proposta por Adolf Karl Ludwig Claus em 1867, também é bastante peculiar, uma vez que as ligações do CC são cruzadas. E o último foi o anel “serpentino” de Kekulé, sonhado em 1865.
Qual foi o “vencedor”? A quinta estrutura (da esquerda para a direita), proposta em 1899 por Johannes Thiele.
Nisso, o híbrido de ressonância foi considerado pela primeira vez, que combinou as duas estruturas de Kekulé (gire o primeiro anel à direita para observá-lo) e explicou extraordinariamente a deslocalização dos elétrons e, com ele, a estabilidade até então incomum do benzeno
Estrutura de benzeno
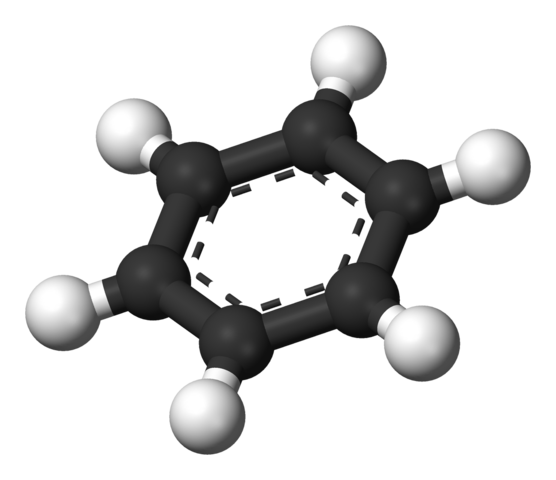
Acima está a estrutura proposta por Thiele através de um modelo de esferas e barras.
A molécula de benzeno é plana, com os átomos de hidrogênio apontando para fora dos lados do anel. Todos os átomos de carbono são sp hibridado 2 , com a orbital p disponível para estabelecer o sistema aromático em que deslocalizada seis electrões.
Estes átomos de carbono sp 2 são mais electronegativo que hidrogénios, e, por conseguinte, a primeira densidade de electrões removidos para a segunda (C sp2 δ- -H δ + ). Consequentemente, o centro do anel tem uma concentração maior de elétrons do que seus lados.
Mais precisamente, o sistema aromático pode ser representado como uma nuvem ou bloco eletrônico dilatado em ambos os lados do anel hexagonal; e no meio, pelos lados ou bordas, uma deficiência eletrônica formada por hidrogênios com carga parcial positiva.
Graças a essa distribuição de cargas elétricas, as moléculas de benzeno podem interagir umas com as outras usando forças dipolo-dipolo; Os átomos de H δ + são atraídos para o centro aromático de um anel vizinho (isso será representado abaixo).
Além disso, os centros aromáticos podem ser empilhados uns sobre os outros para favorecer a indução de dipolos instantâneos.
Ressonância

Na parte superior da imagem são mostradas as duas estruturas de Kekulé, e abaixo delas, o híbrido de ressonância. À medida que as duas estruturas se seguem repetidamente, o híbrido é representado com um círculo desenhado no meio (semelhante ao de uma “rosca hexagonal”).
O círculo do híbrido é importante porque indica o caráter aromático do benzeno (e o de muitos outros compostos). Além disso, ele observa que os links não são tão longos quanto CC, nem tão curtos quanto C = C; mas seu comprimento é entre as duas extremidades. Assim, o benzeno não é considerado um polieno.
O exposto acima foi demonstrado medindo-se os comprimentos das ligações CC (139 pm) do benzeno, que são ligeiramente maiores que as ligações CH (109 pm).
Cristais
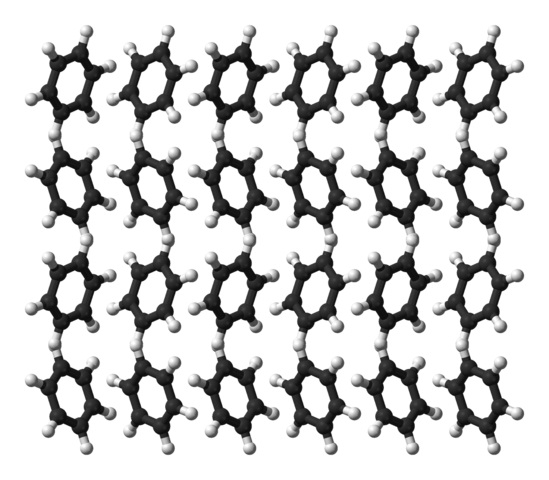
O benzeno é um líquido à temperatura ambiente. Suas forças intermoleculares significam que, apesar de não ter um momento dipolar tão pronunciado, ele pode manter suas moléculas unidas em um líquido que ferve a 80 ° C. Quando a temperatura cai abaixo de 5 ° C, o benzeno começa a congelar e, assim, seus cristais correspondentes são obtidos.
Os anéis de benzeno podem adotar padrões estruturais definidos em seus sólidos. Seus dipolos os fazem “inclinar” para a esquerda ou direita, formando fileiras capazes de se reproduzir por meio de uma célula unitária ortorrômbica. Assim, os cristais de benzeno são ortorrômbicos.
Observe na imagem acima que, quando os anéis são inclinados, as interações entre o H δ + e os centros aromáticos mencionados nas subseções anteriores são favorecidas .
Propriedades
Massa molecular
78,114 g / mol.
Aparência física
Líquido incolor com um cheiro semelhante à gasolina.
Ponto de ebulição
80 ° C
Ponto de fusão
5.5 ° C.
Ponto de inflamação
-11ºC (copo fechado).
Temperatura de auto ignição
497,78 ° C.
Densidade
0,8765 g / mL a 20 ° C.
Solubilidade
Um litro de água fervente mal pode dissolver 3,94 g de benzeno. Seu caráter apolar torna praticamente imiscível com a água. No entanto, é miscível com outros solventes, como etanol, éteres, acetona, óleos, clorofórmio, tetracloreto de carbono, etc.
Densidade de vapor
2,8 em relação ao ar (ou seja, quase três vezes mais denso).
Pressão de vapor
94,8 mm Hg a 25 ° C.
Calor de combustão
-3267,6 kJ / mol (para benzeno líquido).
Calor de vaporização
33,83 kJ / mol.
Tensão superficial
28,22 mN / m a 25 ° C.
Índice de refração
1,5011 a 20 ° C.
Derivados
Os hidrogênios do benzeno podem ser substituídos por outros grupos ou átomos. Pode haver uma ou mais substituições, aumentando o grau de substituição até que nenhum dos seis hidrogênios originais permaneça.
Por exemplo, assuma o benzeno como Ph-H, onde H é um de seus seis hidrogênios. Lembrando que o centro do anel possui maior densidade de elétrons, atrai eletrófilos, que atacam o anel para substituir o H em uma reação chamada substituição eletrofílica aromática (SEAr).
Se este H for substituído por um OH, o Ph-OH, fenol; substituído por um grupo CH 3 , Ph-CH 3 , tolueno; se é NH 2 , Ph-NH 2 , anilina; ou representa um grupo CH 2 CH 3 , Ph-CH 2 CH 3 , etilbenzeno.
Os derivados podem ser os mesmos ou mais tóxicos que o benzeno ou, pelo contrário, tornam-se tão complexos que têm um efeito farmacológico desejável.
Usos
É um bom solvente para uma ampla variedade de compostos, presente, por exemplo, em tintas, vernizes, adesivos e revestimentos.
Também pode dissolver óleos, gorduras ou ceras, sendo usado como solvente extrator de essência. Essa propriedade foi usada por Ludwig Roselius em 1903 para descafeinar o café, uma operação que não estava mais em uso devido à toxicidade do benzeno. Também foi usado no passado para desengordurar metais.
Em um de seus usos clássicos, ele não atua como solvente, mas como aditivo: aumente a taxa de octanas da gasolina, substituindo o chumbo para esse fim.
Derivados de benzeno podem ter usos diferentes; Alguns servem como pesticidas, lubrificantes, detergentes, plásticos, explosivos, perfumes, corantes, colas, drogas, etc. Se um anel de benzeno é observado em sua estrutura, é bem provável que sua síntese tenha começado a partir do benzeno.
Entre seus derivados mais importantes estão: cumeno, xileno, anilina, fenol (para a síntese de resinas fenólicas), ácido benzóico (conservante), ciclo-hexano (para a síntese de nylon), nitrobenzeno, resorcinol e etilbenzeno.
Nomenclatura
A nomenclatura dos derivados de benzeno varia dependendo do grau de substituição, quais são os grupos substituintes e suas posições relativas. Assim, o benzeno pode sofrer substituições mono, di, tri, tetra, etc.
Quando os dois grupos estão ligados a carbonos adjacentes, é usada a denominação “orto”; se houver um carbono entre separá-los, ‘objetivo’; e se os carbonos estiverem em posições opostas, ‘para’.
Exemplos de derivados de benzeno com seus respectivos nomes governados pelo IUPAC são mostrados nas imagens abaixo. Eles também são acompanhados por nomes comuns ou tradicionais.


Observe que no benzeno trissubstituído, os indicadores orto, para e objetivo não são mais úteis.
Toxicidade
O benzeno é um composto que deve ser manuseado com cuidado. Dado seu cheiro particular, os efeitos negativos imediatos podem ser asfixia, tontura, dor de cabeça, tremores, sonolência, náusea e até morte (em alta exposição). Se ingerido, além do que já foi mencionado, pode causar dores de estômago e convulsões agudas.
Além disso, os efeitos a longo prazo sob exposição constante a esse líquido são cancerígenos; Aumenta a probabilidade de o indivíduo sofrer de algum tipo de câncer, especialmente o câncer de sangue: a leucemia.
No sangue, pode reduzir a concentração de glóbulos vermelhos, causando anemia, além de afetar a medula óssea e o fígado, onde é assimilado pelo organismo para gerar derivados de benzeno ainda mais tóxicos; por exemplo, hidroxiquinona. Também se acumula nos rins, coração, pulmões e cérebro.
Referências
- Morrison, RT e Boyd, RN (1987). Quimica Organica. (5ª Edição). Addison-Wesley Iberoamericana.
- Carey, FA (2008). Quimica Organica. (6ª Edição). McGraw-Hill, Interamerica, Editores SA
- Graham Solomons TW, Craig B. Fryhle. (2011). Química Orgânica Aminas (10ª edição). Wiley Plus
- Centro Nacional de Informação Biotecnológica. (2019). Benzeno Banco de Dados PubChem. CID = 241, recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia (2019). Benzeno Recuperado de: en.wikipedia.org
- Garcia Nissa (2019). O que é benzeno? – Usos, Estrutura e Fórmula. Estudo Recuperado de: study.com
- Centros de Controle e Prevenção de Doenças. (4 de abril de 2018). Fatos sobre benzeno. Recuperado de: emergency.cdc.gov
- Organização Mundial da Saúde (2010). Exposição ao benzeno: um grande problema de saúde pública. [PDF]. Recuperado de: who.int
- Fernández Germán. (sf). Problemas na nomenclatura do benzeno. Quimica Organica. Recuperado de: quimicaorganica.org