A Beta galactosidase , β-galactosidase também chamado β-D-ou galactohydrolase é uma enzima pertencente à família das glicosil hidrolases capazes de hidrolisar os resíduos de galactosilo, de diferentes tipos de moléculas: oligossacáridos e polímeros, metabolitos secundários, entre outros.
Anteriormente conhecida como «lactase», sua distribuição, assim como a dos polissacarídeos oligo e β-galactosidados que servem como substrato, é extremamente ampla. Pode ser encontrada em bactérias, fungos e leveduras; Nas plantas é comum em amêndoas, pêssegos, damascos e maçãs, e em animais está presente em órgãos como estômago e intestino.
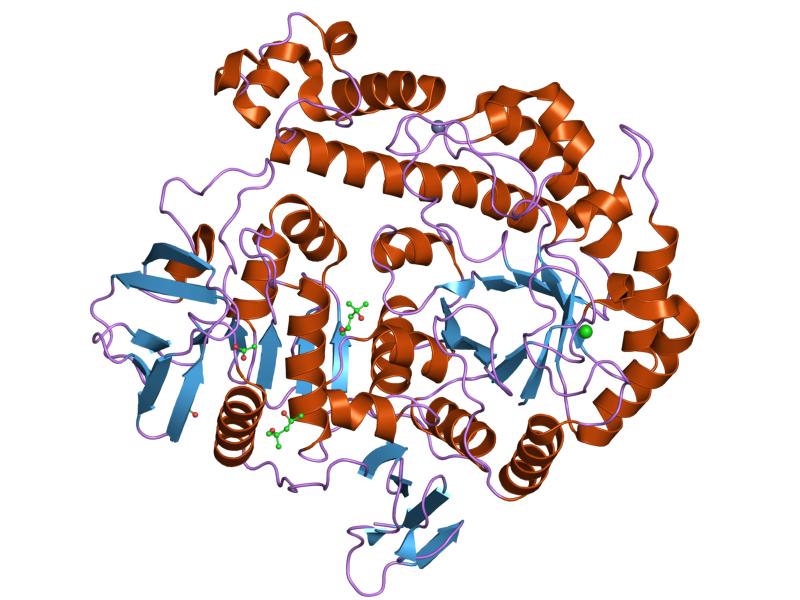
A enzima mais estudada é a do operon E. coli Lac , codificado pelo gene lacZ , cujos estudos foram fundamentais para entender o funcionamento dos operons genéticos e muitos aspectos regulatórios.
Atualmente, pertence ao grupo das enzimas mais estudadas e sua função mais conhecida é a da hidrólise das ligações glicosídicas da lactose. Desempenha funções metabólicas essenciais nos organismos que a expressam e também é usado para diferentes fins industriais.
Entre aplicações industriais estão a remoção de lactose de produtos lácteos para pessoas intolerantes à lactose e a produção de vários compostos galactosidados. Eles também são usados para melhorar a doçura, sabor e digestão de muitos produtos lácteos.
Caracteristicas
Além de substratos galactosidados, como a lactose, a maioria das β-galactosidases conhecidas requer íons metálicos divalentes, como magnésio e sódio. Isto foi provado com a descoberta dos locais de ligação para os referidos metais em sua estrutura.
As β-galactosidases presentes na natureza têm uma ampla variedade de faixas de pH nas quais elas podem trabalhar. As enzimas fúngicas trabalham em ambientes ácidos (de 2,5 a 5,4), enquanto as de leveduras e bactérias trabalham entre 6 e 7 unidades de pH.
β-galactosidases bacterianas
As bactérias têm grandes enzimas galacto-hidrolíticas em comparação com outras galactosidases analisadas. Nesses organismos, a mesma enzima catalisa três tipos de reações enzimáticas:
– Hidrolisa a lactose em seus monossacarídeos constitutivos: galactose e glicose.
– Catalisa a transgalactosilação da lactose em alolactose, um açúcar dissacarídeo que participa da regulação positiva da expressão de genes pertencentes ao Lac operon , eç.
– Hidrolisa a alolactose de maneira semelhante à da lactose.
β-galactosidases fúngicas
Os fungos possuem enzimas β-galactosidase mais suscetíveis à inibição da galactose do que as enzimas pertencentes a outros organismos. No entanto, estes são termoestáveis e funcionam em faixas de pH ácido.
O metabolismo da lactose mediado por essas enzimas nos fungos é dividido em extracelular e citosólico, uma vez que esses organismos podem usar a β-galactosidase para hidrolisar a lactose extracelularmente e introduzir produtos nas células ou eles podem pegar o dissacarídeo diretamente e processá-lo internamente.
Estrutura
A enzima β-galactosidase bacteriana é uma enzima tetramérica (de quatro subunidades idênticas, AD) e cada um de seus monômeros possui mais de 1.000 resíduos de aminoácidos, o que significa um peso molecular de mais de 100 kDa para cada um e mais de 400 kDa para proteína complexada.
Nas plantas, por outro lado, a enzima é de tamanho consideravelmente menor e pode ser encontrada como um dímero de subunidades idênticas.
Os domínios de cada monômero são distinguidos com os números de 1 a 5. O domínio 3 tem uma estrutura de barril α / β “TIM” e tem o local ativo na extremidade C-terminal do barril.
Presume-se que os locais ativos do complexo enzimático sejam compartilhados entre os monômeros, portanto essa enzima é biologicamente ativa somente quando complexada como tetrâmero.
Seu sítio ativo tem a capacidade de ligar D-glicose e D-galactose, os dois monossacarídeos que compõem a lactose. É particularmente específico para a D-galactose, mas não é tão específico para a glicose; portanto, a enzima pode atuar em outros galactosídeos.
Funções
Em animais
No intestino humano, a principal função dessa enzima tem a ver com a absorção da lactose ingerida com os alimentos, pois está localizada na face luminal da membrana plasmática das células intestinais na forma de uma escova.
Além disso, foi demonstrado que as isoformas lisossômicas dessa enzima participam na degradação de muitos glicolipídios, mucopolissacarídeos e glicoproteínas galactosidadas, que têm vários propósitos em diferentes vias celulares.
Em plantas
As plantas possuem enzimas β-galactosidases nas folhas e sementes. Estes desempenham funções importantes no catabolismo dos galactolipídeos, que são característicos das algas e plantas em geral.
Nesses organismos, a β-galactosidase participa dos processos de crescimento das plantas, amadurecimento das frutas e, nas plantas superiores, é a única enzima conhecida capaz de hidrolisar os resíduos de galactosil dos polissacarídeos galacosidados da parede celular.
Na indústria e na pesquisa
Na indústria de alimentos relacionados a laticínios, a enzima β-galactosidase é usada para catalisar a hidrólise da lactose presente nos laticínios, responsável por muitos dos defeitos relacionados ao armazenamento desses produtos.
A hidrólise desse açúcar procura evitar a sedimentação de partículas, a cristalização de sobremesas lácteas congeladas e a presença de texturas “arenosas” na maioria dos derivados comerciais de leite.
A β-galactosidase utilizada industrialmente é comumente obtida do fungo Aspergillus sp., Embora a enzima produzida pela levedura Kluyveromyces lactis também seja amplamente utilizada.
A atividade da β-galactosidase, traduzida em termos científicos como ” fermentação de lactose”, é rotineiramente testada para a identificação de enterobactérias gram-negativas presentes em diferentes tipos de amostras.
Além disso, em termos médicos, é usado para a produção de laticínios sem lactose e para a formulação de comprimidos usados por pessoas intolerantes à lactose para digerir o leite e seus derivados (iogurte, queijo, sorvete, manteiga, cremes, etc.) .
É usado como um “biossensor” ou “biomarcador” com diversos propósitos, desde imunoensaios e análises toxicológicas até análises da expressão gênica e diagnóstico de patologias, graças à imobilização química dessa enzima em suportes especiais.
Referências
- Henrissat, B. & Daviest, G. (1997). Classificação estrutural e sequencial das hidrolases glicosídicas. Current Biology , 7 , 637-644.
- Huber, R. (2001). Beta (B) -Galactosidase. Academic Press , 212-214.
- Husain, Q. (2010). β Galactosidases e suas possíveis aplicações: uma revisão. Critical Reviews in Biotechnology , 30 , 41–62.
- Juers, DH, Matthews, BW e Huber, RE (2012). LacZ B-galactosidase: Estrutura e função de uma enzima de importância biológica histórica e molecular. Protein Science , 21 , 1792-1807.
- Lee, BY, Han, JA, Im, JS, Morrone, A., Johung, K., Goodwin, C., … Hwang, ES (2006). A β-galactosidase associada à senescência é a β-galactosidase lisossômica. Cell Envelhecimento , 5 , 187-195.
- Matthews, BW (2005). A estrutura da β-galactosidase de E. coli. CR Biologies , 328 , 549-556.
- Mccarter, JD, & Withers, SG (1994). Mecanismos de hidrólise enzimática de glicosídeo. Opinião Atual em Biologia Estrutural , 4 , 885-892.
- Richmond, M., Gray, J. e Stine, C. (1981). Beta-Galactosidase: Revisão de pesquisas recentes relacionadas à aplicação tecnológica, preocupações nutricionais e imobilização. J. Dairy Sci , 64 , 1759–1771.
- Wallenfels, K. & Weil, R. (1972). B-galactosidase.