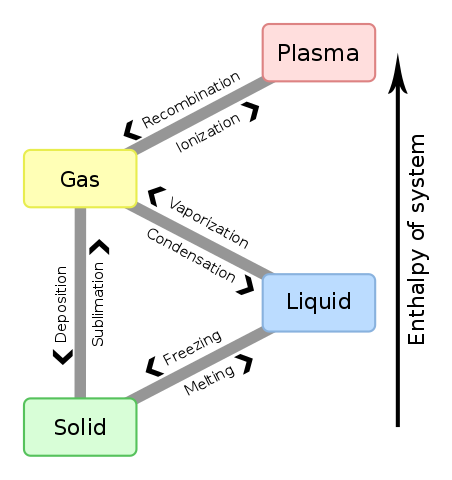
Calor latente é a quantidade de energia térmica necessária para provocar mudanças de estado físico em uma substância, sem que haja variação de temperatura. Os principais processos que envolvem calor latente são: fusão (passagem do estado sólido para o líquido), vaporização (passagem do estado líquido para o gasoso), solidificação (passagem do estado líquido para o sólido) e condensação (passagem do estado gasoso para o líquido). Esses processos são fundamentais para entender as propriedades termodinâmicas das substâncias e são de extrema importância em diversas áreas da ciência e da tecnologia.
Descubra os cinco tipos de calor latente e suas aplicações na física e na natureza.
Calor latente é a quantidade de energia térmica necessária para alterar o estado físico de uma substância, sem que haja mudança de temperatura. Existem cinco tipos de calor latente: fusão, vaporização, solidificação, condensação e sublimação. Cada um desses tipos tem suas próprias aplicações na física e na natureza.
O calor latente de fusão é a energia necessária para transformar uma substância do estado sólido para o líquido, sem alterar a temperatura. Um exemplo disso é o gelo derretendo em água. Na natureza, esse processo é essencial para manter o equilíbrio térmico nos oceanos e lagos.
O calor latente de vaporização é a energia necessária para transformar uma substância do estado líquido para o gasoso, sem alterar a temperatura. Um exemplo é a água fervendo e se transformando em vapor. Na física, esse processo é utilizado em sistemas de refrigeração e na produção de energia em usinas termoelétricas.
A solidificação é o inverso da fusão, onde a energia é liberada para transformar uma substância do estado líquido para o sólido. Um exemplo é a água se transformando em gelo. Na natureza, a solidificação é fundamental na formação de cristais de gelo e na regulação do clima terrestre.
A condensação é o oposto da vaporização, onde a energia é liberada para transformar uma substância do estado gasoso para o líquido. Um exemplo é o vapor de água se transformando em gotas de chuva. Na física, a condensação é importante para a formação de nuvens e para a produção de energia em usinas nucleares.
Eles desempenham um papel crucial em diversos fenômenos naturais e em aplicações tecnológicas que utilizam a energia térmica de forma eficiente.
Significado do calor latente de fusão e vaporização: entenda esses conceitos importantes na termodinâmica.
Calor latente é a quantidade de calor necessária para que uma substância mude de fase sem que sua temperatura se altere. Os principais processos que envolvem calor latente são a fusão, a vaporização, a solidificação e a condensação.
O calor latente de fusão é a quantidade de calor necessária para que uma substância sólida se transforme em líquido, mantendo a temperatura constante. Esse processo ocorre quando a energia térmica é fornecida à substância, fazendo com que as moléculas se movam mais rapidamente e se separem, rompendo as ligações intermoleculares.
Por outro lado, o calor latente de vaporização é a quantidade de calor necessária para que uma substância líquida se transforme em vapor, também mantendo a temperatura constante. Nesse processo, as moléculas ganham energia suficiente para romper as ligações intermoleculares e se transformar em estado gasoso.
Esses conceitos são fundamentais na termodinâmica, pois permitem entender como a energia térmica é absorvida ou liberada durante as mudanças de fase das substâncias. Compreender o calor latente de fusão e vaporização é essencial para diversos campos da ciência, como a física, a química e a engenharia.
Entenda as seis transformações de estado da matéria em sua forma física.
Calor latente é a quantidade de calor necessária para que ocorra uma mudança de fase da matéria, sem que haja variação de temperatura. As seis transformações de estado da matéria em sua forma física são: fusão, vaporização, solidificação, condensação, sublimação e inversão.
A fusão é a transformação do estado sólido para o estado líquido, onde é necessário fornecer calor para que as partículas se movimentem mais e se separem umas das outras. Já a vaporização é a passagem do estado líquido para o estado gasoso, onde também é necessário fornecer calor para que as partículas se movimentem com mais intensidade e se dispersem no ambiente.
Por outro lado, a solidificação é o processo inverso da fusão, onde o calor é retirado da substância para que as partículas se movimentem menos e se unam, passando do estado líquido para o estado sólido. Já a condensação é o processo inverso da vaporização, onde o calor é retirado do vapor para que as partículas se movimentem menos e se agrupem, passando do estado gasoso para o estado líquido.
A sublimação é a transformação direta do estado sólido para o estado gasoso, sem passar pelo estado líquido, e a inversão é o processo inverso, do estado gasoso para o estado sólido, sem passar pelo estado líquido. Ambos os processos envolvem a adição ou retirada de calor para que as partículas mudem de posição e se organizem de forma diferente.
Portanto, o calor latente é fundamental para entender as transformações de estado da matéria e como as partículas se comportam em cada uma dessas situações, permitindo compreender melhor as propriedades físicas e químicas dos materiais que nos rodeiam.
Significado e importância do calor latente de condensação na mudança de fase da água.
O calor latente de condensação é a quantidade de calor que precisa ser absorvida pela água para que ocorra a mudança de fase de vapor para líquido. Este processo é de extrema importância na natureza, pois está presente em fenômenos como a formação de nuvens e a ocorrência de chuva.
Quando o vapor de água presente na atmosfera se resfria, ele perde energia térmica e se condensa em gotículas de água. Neste momento, o calor latente de condensação é liberado, aquecendo o ar ao redor e formando as nuvens. Quando essas gotículas se acumulam e se tornam muito pesadas, a água cai na forma de chuva.
É importante ressaltar que o calor latente de condensação tem um papel fundamental no equilíbrio climático da Terra. Ele atua como um mecanismo de regulação da temperatura, pois absorve calor do ambiente durante a evaporação da água e o libera durante a condensação, ajudando a manter a temperatura estável.
Ele é responsável por fenômenos como a formação de nuvens e a ocorrência de chuva, influenciando diretamente a vida na Terra.
Calor latente: fusão, vaporização, solidificação, condensação
O calor latente é aquele que não é “sentido”, pois representa a energia térmica que é liberada ou absorvida durante uma mudança de fase, sem aumentar ou diminuir a temperatura do sistema termodinâmico. Existem vários tipos de calor latente, que são governados pelas mudanças de fase de uma substância.
Os tipos de calor latente são o calor latente de fusão, vaporização, solidificação e condensação. Em outras palavras, esses valores são as unidades de calor por massa necessárias para atingir a mudança de fase. No campo da termodinâmica, o estudo da transferência de calor e dos efeitos térmicos é comum.
Esses efeitos estão envolvidos em qualquer processo, mesmo aqueles que ocorrem a uma temperatura constante.Os dois tipos de calor que podem ser transferidos para um corpo ou substância e o ambiente circundante durante um processo são observados, que são governados pelas propriedades individuais da substância envolvida: calor sensível e calor latente .
Calor sensível refere-se ao calor que é ” sentido” ou medido no processo através de mudanças na temperatura corporal. Por outro lado, o calor latente refere-se ao momento em que a energia é absorvida ou liberada sem gerar mudanças de temperatura.
Calor latente de fusão
A fusão é um processo físico que é representado como a transição de fase de uma substância do sólido para o líquido. Portanto, o calor latente de fusão de uma substância, ou entalpia de fusão, é a mudança de entalpia que resulta da absorção de energia e que leva a substância em questão a passar da fase sólida para a fase líquida a pressão constante.
A temperatura na qual essa transição ocorre é denominada temperatura de fusão e a pressão 1 atm ou 101 325 kPa é assumida, dependendo do sistema trabalhado.
Graças à diferença de forças intermoleculares, as moléculas em uma fase líquida possuem maior energia interna que um sólido, portanto, os sólidos precisam de uma energia positiva (absorver calor) para derreter e atingir o líquido, enquanto os líquidos devem libere o calor para congelar (solidificar).
Essa alteração de entalpia pode ser aplicada a qualquer quantidade de substância que atinja a fusão, por menor que seja, e é um valor constante (a mesma quantidade de energia) que é expressa em unidades de kJ / kg quando se deseja consultar unidades de massa
É sempre uma quantidade positiva, exceto no caso do hélio, o que significa que o hélio congela com a absorção de calor. O calor latente do valor de fusão da água é de 333,55 kJ / kg.
Calor latente de vaporização
Também chamada entalpia de vaporização, é a quantidade de energia que deve ser adicionada a uma substância na fase líquida para que ela faça uma transição para a fase gasosa. Este valor é uma função da pressão na qual a transformação ocorre.
Geralmente está associado ao ponto de ebulição normal de uma substância, ou seja, o ponto de ebulição que ela possui quando a pressão de vapor do líquido é igual à pressão atmosférica ao nível do mar (1 atm).
O calor da vaporização depende da temperatura, embora se possa presumir que permanece constante em pequenas faixas de temperatura e em temperaturas muito inferiores a uma.
Além disso, é importante denotar que o calor da vaporização está diminuindo a altas temperaturas, até atingir a chamada temperatura crítica da substância, onde são equacionadas. Além da temperatura crítica, as fases de vapor e líquido se tornam indiferentes, e a substância fica em um estado de fluido supercrítico.
Matematicamente, é expresso como o aumento de energia da fase de vapor em comparação com a energia na fase líquida, mais o trabalho que deve ser aplicado contra a pressão atmosférica.
O primeiro termo (aumento de energia) será a energia necessária para superar as interações intermoleculares que existem no líquido, onde as substâncias com maiores forças entre as ligações (água, por exemplo) terão maiores calor latentes de vaporização (2257 kJ / Kg ) do que aqueles com pouca força entre seus elos (21 kJ / Kg).
Calor latente de solidificação
O calor latente da solidificação é o calor envolvido na mudança de fase de uma substância de líquido para sólido. Como mencionado anteriormente, as moléculas de uma substância na fase líquida possuem maior energia interna do que as sólidas, de modo que a solidificação libera energia em vez de absorvê-la, como na fusão.
Então, em um sistema termodinâmico, pode-se dizer que o calor latente da solidificação é o oposto ao da fusão, uma vez que a energia envolvida é liberada para o exterior quando ocorre a mudança de fase.
Ou seja, se o valor do calor latente de fusão da água for 333,55 kJ / kg, o valor do calor latente da solidificação ou congelamento da água será de -333,55 kJ / kg.
Calor latente de condensação
O calor latente da condensação é aquele que ocorre quando há uma mudança de fase de uma substância gasosa para um líquido, como no caso do vapor de água.
No que diz respeito à energia de cada molécula, nos gases é ainda maior que nos líquidos, de modo que uma liberação de energia também ocorre quando passa da primeira fase para a segunda.
Novamente, pode-se dizer que o valor do calor latente de condensação será o mesmo que o da vaporização, mas com um valor negativo. Então, um valor de condensação de calor latente para a água será igual a -2257 kJ / Kg.
Em temperaturas mais altas, o calor da condensação diminuirá, enquanto o ponto de ebulição aumentará.
Referências
- Calor latente. (sf). Obtido em en.wikipedia.org
- Smith, JM, Van Ness, HC, & Abbott, MM (2007). Introdução à Termodinâmica da Engenharia Química. México: McGraw-Hill.
- Levine, I. (2002). Química Física Madri: McGraw-Hill.
- Poder, N. (sf). Energia Nuclear Obtido em nuclear-power.net
- Elert, G. (sf). O hipertexto de física. Obtido de physics.info