Uma célula eletrolítica é um dispositivo que transforma energia elétrica em energia química, através de um processo conhecido como eletrólise. Ela é composta por um recipiente contendo uma solução eletrolítica, dois eletrodos (um positivo e um negativo), e uma fonte de energia elétrica. O funcionamento da célula eletrolítica se baseia na passagem de corrente elétrica através da solução eletrolítica, o que provoca reações químicas nos eletrodos e na solução.
As aplicações das células eletrolíticas são diversas, sendo utilizadas em processos industriais, laboratoriais e até mesmo em dispositivos do dia a dia, como baterias recarregáveis e produção de gases para soldagem. Além disso, a eletrólise é fundamental em processos como a purificação de metais, produção de cloro e soda cáustica, entre outros. Em resumo, as células eletrolíticas desempenham um papel crucial em diversas áreas da ciência e da indústria.
Entendendo o funcionamento de uma célula eletrolítica: processo eletroquímico de separação de substâncias.
Uma célula eletrolítica é um dispositivo que utiliza energia elétrica para promover reações químicas não espontâneas. Ela é composta por dois eletrodos (um positivo e um negativo) imersos em uma solução eletrolítica. Quando uma corrente elétrica é aplicada aos eletrodos, ocorrem reações de oxirredução que resultam na separação de substâncias.
Os eletrodos são feitos de materiais condutores, como o grafite ou o platina, e são conectados a uma fonte de energia elétrica. A solução eletrolítica é composta por íons que podem ser oxidados ou reduzidos durante o processo. Quando a corrente elétrica passa pelos eletrodos, íons positivos migram em direção ao cátodo (eletrodo negativo) e íons negativos migram em direção ao ânodo (eletrodo positivo).
As reações químicas que ocorrem nos eletrodos geram produtos diferentes, dependendo da natureza dos reagentes e das condições da célula eletrolítica. Por exemplo, na eletrólise da água, a água é decomposta em oxigênio e hidrogênio gasosos. Esse processo é muito utilizado na indústria para a obtenção de substâncias puras e na produção de metais a partir de seus minérios.
Em resumo, a célula eletrolítica é um dispositivo que utiliza energia elétrica para promover reações químicas não espontâneas, resultando na separação de substâncias. É um processo eletroquímico fundamental em diversas áreas, como na produção de metais, na purificação de substâncias e na fabricação de produtos químicos.
Entenda o funcionamento do processo eletrolítico e sua importância na indústria moderna.
A célula eletrolítica é um dispositivo utilizado para realizar processos eletrolíticos, que consistem na passagem de corrente elétrica através de um eletrólito para promover reações químicas. Este processo é fundamental em diversas aplicações industriais, como na produção de metais, tratamento de superfícies, fabricação de produtos químicos e na reciclagem de materiais.
A célula eletrolítica é composta por duas partes principais: o cátodo e o ânodo, que são conectados a uma fonte de energia elétrica. No cátodo ocorre a redução de íons, enquanto no ânodo ocorre a oxidação. O eletrólito utilizado pode ser líquido ou sólido, e é responsável por conduzir a corrente elétrica entre as duas partes da célula.
O funcionamento da célula eletrolítica ocorre da seguinte forma: quando a corrente elétrica é aplicada, os íons presentes no eletrólito são atraídos para os eletrodos, onde sofrem as reações de oxidação e redução. Essas reações resultam na formação de produtos químicos desejados, que podem ser separados e utilizados na indústria.
A importância do processo eletrolítico na indústria moderna é inegável, pois permite a produção de materiais de forma mais eficiente, limpa e sustentável. Além disso, o uso de células eletrolíticas possibilita a obtenção de produtos de alta pureza, o que é essencial em setores como a indústria de semicondutores e a fabricação de dispositivos eletrônicos.
Em resumo, a célula eletrolítica é um componente essencial para a realização de processos eletrolíticos na indústria, contribuindo para a fabricação de diversos produtos e materiais que fazem parte do nosso cotidiano. Seu funcionamento simples e eficaz tem um papel fundamental no desenvolvimento tecnológico e na busca por soluções mais sustentáveis e inovadoras.
Principais usos da eletroquímica: descubra as aplicações dessa ciência fundamental na sociedade moderna.
A eletroquímica é uma ciência fundamental que tem uma variedade de aplicações importantes na sociedade moderna. Uma das principais utilizações da eletroquímica é nas baterias recarregáveis, que são essenciais para dispositivos eletrônicos como smartphones, laptops e carros elétricos. Além disso, a eletroquímica também é utilizada em processos de galvanização, que protegem metais da corrosão, e na produção de produtos químicos como o cloro e o hidrogênio.
Outra aplicação importante da eletroquímica é na purificação de metais, como o alumínio e o cobre, que são amplamente utilizados na indústria. Além disso, a eletroquímica também desempenha um papel crucial na análise de substâncias químicas, através de técnicas como a cromatografia e a espectroscopia eletroquímica.
Em resumo, a eletroquímica é uma ciência fundamental com uma variedade de aplicações importantes na sociedade moderna, desde baterias recarregáveis até processos de galvanização e purificação de metais. Seu impacto é sentido em diversos setores, tornando-a uma área de estudo essencial para o avanço tecnológico e industrial.
Conceito e funcionamento de uma célula eletroquímica: entenda como ocorre a reação química.
Uma célula eletroquímica é um dispositivo que converte energia química em energia elétrica por meio de uma reação química. Ela é composta por dois eletrodos (um ânodo e um cátodo) e um eletrólito que permite o fluxo de íons entre eles.
No funcionamento de uma célula eletroquímica, a reação química ocorre no ânodo, onde há oxidação, e no cátodo, onde ocorre a redução. Os elétrons fluem do ânodo para o cátodo através de um circuito externo, gerando corrente elétrica. O eletrólito permite a transferência de íons para manter a neutralidade de carga.
As células eletroquímicas são amplamente utilizadas em diversas aplicações, como baterias recarregáveis, células de combustível e eletrodeposição de metais. Elas desempenham um papel fundamental em nossa sociedade, fornecendo energia para dispositivos eletrônicos, veículos elétricos e muito mais.
Em resumo, as células eletroquímicas são dispositivos que convertem energia química em energia elétrica por meio de reações químicas nos eletrodos. Elas desempenham um papel crucial em diversas aplicações e são essenciais para o funcionamento de muitos dispositivos do nosso dia a dia.
Célula eletrolítica: partes, como funciona e aplicações
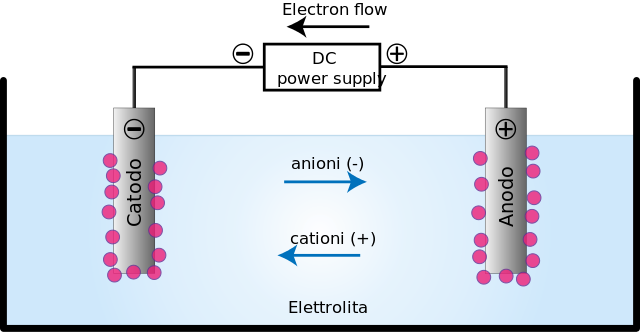
A célula eletrolítica é um meio em que energia ou corrente elétrica são usadas para realizar uma reação de redução de óxido não espontânea. Consiste em dois eletrodos: o ânodo e o cátodo.
No ânodo (+) ocorre a oxidação, pois neste local alguns elementos ou compostos perdem elétrons; enquanto no cátodo (-), a redução, pois nele alguns elementos ou compostos ganham elétrons.

Na célula eletrolítica, a decomposição de algumas substâncias, previamente ionizadas, ocorre através de um processo conhecido como eletrólise.
A aplicação da corrente elétrica produz uma orientação no movimento dos íons na célula eletrolítica. Os íons carregados positivamente (cátions) migram para o cátodo de carga (-).
Enquanto isso, íons carregados negativamente (ânions) migram para o ânodo carregado (+). Essa transferência de carga constitui uma corrente elétrica (imagem superior).Nesse caso, a corrente elétrica é conduzida por soluções eletrolíticas, presentes no recipiente da célula eletrolítica.
A Lei de Eletrólise de Faraday afirma que a quantidade de substância que sofre oxidação ou redução em cada eletrodo é diretamente proporcional à quantidade de eletricidade que passa através da célula ou célula.
Peças
Uma célula eletrolítica é composta de um recipiente onde é depositado o material que sofrerá as reações induzidas pela carga elétrica.
A embarcação possui um par de eletrodos que se conectam a uma bateria de corrente contínua. Os eletrodos geralmente usados são de material inerte, ou seja, eles não interferem nas reações.
Em série com a bateria, um amperímetro pode ser conectado para medir a intensidade da corrente que flui através da solução eletrolítica. Além disso, um voltímetro é colocado em paralelo para medir a diferença de voltagem entre o par de eletrodos.
Como funciona uma célula eletrolítica?
Eletrólise do cloreto de sódio fundido
É preferível usar cloreto de sódio fundido em cloreto de sódio sólido, uma vez que este último não conduz eletricidade. Os íons vibram dentro de seus cristais, mas não estão livres para se mover.
Reação catódica
Eletrodos de grafite, um material inerte, são conectados aos terminais da bateria. Um eletrodo é conectado ao terminal positivo da bateria, constituindo o ânodo (+).
Enquanto isso, o outro eletrodo é conectado ao terminal negativo da bateria, constituindo o cátodo (-). Quando a corrente da bateria flui, é observado o seguinte:
No cátodo (-) há uma redução do íon Na + , que quando eles ganham um elétron se tornam Na metálicos:
Na + + e – => Na (l)
O sódio metálico branco-prateado flutua sobre cloreto de sódio fundido.
Reação do ânodo
Pelo contrário, no ânodo (+) ocorre a oxidação do íon Cl – , uma vez que perde elétrons e é transformado em gás cloro (Cl 2 ), processo que se manifesta pela aparência no ânodo de um gás de cor verde pálida. A reação que ocorre no ânodo pode ser esquematizada, assim:
2Cl – => Cl 2 (g) + 2 e –
A formação de gás metálico Na e Cl 2 a partir de NaCl não é um processo espontâneo, exigindo temperaturas superiores a 800 ° C. A corrente elétrica fornece a energia para a transformação indicada nos eletrodos da célula eletrolítica.
Os elétrons são consumidos no cátodo (-), no processo de redução e são produzidos no ânodo (+) durante a oxidação. Portanto, os elétrons fluem através do circuito externo da célula eletrolítica do ânodo para o cátodo.
A bateria de corrente contínua fornece energia para os elétrons fluírem não espontaneamente do ânodo (+) para o cátodo (-).
Célula para baixo
A célula Down é uma adaptação da célula eletrolítica descrita e usada para a produção industrial de Na metálico e gás cloro.
A célula eletrolítica de Down possui dispositivos que permitem a coleta, separadamente, de sódio metálico e gás cloro. Este método de produção de sódio metálico ainda é muito prático.
Uma vez liberado por eletrólise, o sódio metálico líquido é drenado, resfriado e cortado em blocos. Posteriormente, é armazenado em um meio inerte, uma vez que o sódio pode reagir explosivamente pelo contato com a água ou o oxigênio atmosférico.
O gás cloro é produzido na indústria, principalmente, pela eletrólise do cloreto de sódio em um processo mais barato que a produção de sódio metálico.
Aplicações
Sínteses industriais
-Na indústria, as células eletrolíticas são usadas no refino e na eletrodeposição de vários metais não ferrosos. Quase todo alumínio, cobre, zinco e chumbo de alta pureza são produzidos industrialmente em células eletrolíticas.
-Hidrogênio é produzido por eletrólise da água. Este procedimento químico também é usado na obtenção de água pesada (D 2 O).
-Metais como Na, K e Mg são obtidos por eletrólise de eletrólitos fundidos. Além disso, não-metais como fluoretos e cloretos são obtidos por eletrólise. Além disso, compostos tais como NaOH, KOH, Na 2 CO 3 e KMnO 4 são sintetizados pelo mesmo procedimento.
Revestimento e refino de metais
-O processo de revestimento de um metal inferior com um metal de qualidade superior é conhecido como galvanoplastia. Seu objetivo é evitar a corrosão do metal inferior e torná-lo mais atraente. Na galvanoplastia, células eletrolíticas são usadas para esse fim.
– Metais impuros podem ser refinados por eletrólise. No caso do cobre, folhas muito finas de metal são colocadas no cátodo e grandes barras de cobre impuro a serem refinadas são colocadas no ânodo.
-O uso de artigos folheados é comum na sociedade. Jóias e louças geralmente prateadas; O ouro é eletrodepositado em itens de joalheria e contatos elétricos. Muitos objetos são revestidos com cobre para fins decorativos.
-Os carros têm peças de defesa e outras peças de aço cromado. O cromagem de uma defesa de carro leva apenas 3 segundos de eletrodeposição de cromo para produzir uma superfície brilhante de 0,0002 mm de espessura.
-Eletrodeposição rápida de metal produz superfícies pretas e ásperas. A eletrodeposição lenta produz superfícies lisas. As “latas” são feitas de aço revestido de estanho por eletrólise. Às vezes, essas latas são cromadas em uma fração de segundo com a espessura da camada extremamente fina de cromo.
Referências
- Whitten, Davis, Peck e Stanley. Química (8a ed.). Aprendizagem CENGAGE.
- Preparação eMedical. (2018). Aplicações de eletrólise. Recuperado de: emedicalprep.com
- Wikipedia (2018). Célula eletrolítica. Recuperado de: en.wikipedia.org
- Shapley P. (2012). Células galvânicas e eletrolíticas. Recuperado de: butane.chem.uiuc.edu
- Bodner Research Web. (sf). Células eletrolíticas. Recuperado de: chemed.chem.purdue.edu