- La stechiometria collega quantità di reagenti e prodotti tramite rapporti in moli e masse.
- Si fonda sulle leggi di Lavoisier, Proust e sulle proporzioni multiple per garantire coerenza.
- Il metodo efficace: bilanciare, impostare proporzioni coerenti e convertire le unità.
- Applicazioni chiave in laboratorio, industria, ambiente e didattica.
La stechiometria è il linguaggio quantitativo della chimica: consente di collegare in modo rigoroso le quantità di reagenti impiegati e di prodotti formati in una trasformazione chimica. In altre parole, traduce una reazione in numeri, prevedendo quanta sostanza serve e quanta si ottiene, sia a livello di laboratorio sia su scala industriale.
Dietro questi calcoli stechiometrici, fasi ed esercizi c’è un insieme di leggi fondamentali e una procedura chiara: scrivere la reazione, bilanciarla, scegliere le specie da mettere in proporzione, impostare una regola del tre coerente e, quando necessario, convertire moli, masse, volumi e numero di particelle. Con un po’ di pratica, la stechiometria diventa una cassetta degli attrezzi essenziale per chiunque studi o applichi la chimica.
Che cos’è la stechiometria
Per stechiometria si intende la relazione quantitativa tra le sostanze che reagiscono tra loro e i prodotti generati in una reazione chimica specifica. Se consideriamo un’equazione del tipo a A + b B → c C, i coefficienti a, b e c sono i coefficienti stechiometrici: indicano la proporzione minima intera in moli con cui i partecipanti reagiscono o si formano.
In termini pratici, significa che a moli di A reagiscono con b moli di B per originare c moli di C. Questi rapporti sono alla base di ogni calcolo: dalle quantità in grammi alle conversioni in litri di gas a CNTP, fino al conteggio delle molecole tramite il numero di Avogadro.
È cruciale ricordare che i coefficienti stechiometrici si scrivono davanti alle formule e non vanno confusi con gli indici in basso: gli indici indicano la composizione della sostanza e non possono essere alterati senza cambiare identità chimica al composto.
Le leggi ponderali: Lavoisier, Proust e le proporzioni multiple
Il comportamento quantitativo delle reazioni è guidato da alcune leggi cardine. La legge di Lavoisier (conservazione della massa) afferma che, in un sistema chiuso, la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti. Questa legge trova conferma sperimentale quando la reazione avviene senza scambi di materia con l’esterno.
La legge di Proust (proporzioni definite) stabilisce che un determinato composto, qualunque sia la sua origine, è formato dagli stessi elementi uniti in una proporzione di massa costante. Così, per esempio, l’acqua è sempre H₂O: due atomi di idrogeno per uno di ossigeno, con proporzione fissa in massa.
A queste si aggiunge la legge delle proporzioni multiple: quando due elementi formano più composti, le masse di uno che si combinano con una massa fissa dell’altro stanno tra loro come numeri interi semplici. Ciò è evidente confrontando CO e CO₂ oppure NO e NO₂: l’ossigeno si combina in rapporti 1:2 in massa, rispettando numeri interi.
Come si fanno i calcoli stechiometrici: metodo in 5 passi
Una procedura ordinata aiuta a non perdersi. I passaggi più efficaci, largamente usati anche nella didattica, sono i seguenti: scrivere la reazione, bilanciarla, individuare le sostanze da mettere in relazione, impostare la regola del tre, convertire le unità per avere coerenza e infine calcolare.
Passo 1 — Scrivere la reazione. Annota l’equazione chimica con reagenti e prodotti. Questa è la fotografia qualitativa del processo che vuoi analizzare, da cui ricaverai poi le proporzioni quantitative.
Passo 2 — Bilanciare l’equazione. Il bilanciamento consiste nel regolare i coefficienti stechiometrici per pareggiare il numero di atomi di ciascun elemento su entrambi i lati. Il metodo delle tentativi è il più praticato e può essere guidato dalla regola MACHO: Metalli, Ametalli, Carbonio, Idrogeno, Ossigeno. Questa sequenza aiuta a scegliere l’ordine con cui bilanciare, senza mai toccare gli indici nella formula.
Esempio di bilanciamento. La sintesi dell’ammoniaca: N₂ + H₂ → NH₃. Si nota che N è 2 a sinistra e 1 a destra, quindi si mette 2 davanti a NH₃: N₂ + 2 NH₃. Ora l’idrogeno è 6 a destra, perciò si inserisce 3 davanti a H₂: N₂ + 3 H₂ → 2 NH₃. Reazione bilanciata.
Passo 3 — Scegliere le sostanze da collegare. Si lavora sempre collegando una quantità nota a quella incognita. Per esempio, se conosci la massa di N₂ e vuoi la massa di NH₃, userai proprio N₂ e NH₃ nella tua proporzione.
Passo 4 — Impostare la regola del tre. La prima riga deve riportare la proporzione stechiometrica tratta dall’equazione bilanciata, preferibilmente in moli. La seconda riga riporta i dati dell’esercizio (la quantità nota e quella da trovare). Se si usano masse o volumi, tutte le grandezze devono essere espresse nella stessa unità per garantire coerenza.
Passo 5 — Convertire e calcolare. Se necessario, converti moli in grammi con la massa molare, oppure in litri se si tratta di gas a CNTP. Poi risolvi la proporzione con una semplice regola del tre.
Esempi svolti e casi tipici
Gli esempi che seguono mostrano come applicare i passaggi appena visti in situazioni molto comuni in esercizi e problemi reali.
Mol con mol: idrogeno e azoto per formare ammoniaca
Reazione bilanciata: N₂ + 3 H₂ → 2 NH₃. Domanda: con 4 mol di N₂, quanti mol di H₂ servono per la sintesi dell’ammoniaca? Dal rapporto stechiometrico 1 mol N₂ : 3 mol H₂, si ottiene X = 4 × 3 = 12 mol di H₂.
Se invece chiedessimo i moli di NH₃ formati, useremmo il rapporto 1 mol N₂ : 2 mol NH₃, quindi 4 mol N₂ danno 8 mol di NH₃.
Mol con massa: quanta massa di H₂ reagisce con 5 mol di O₂
Reazione: 2 H₂ + O₂ → 2 H₂O. Dati: O₂ = 5 mol; incognita: grammi di H₂. Dalla reazione, 1 mol O₂ reagisce con 2 mol H₂; per 5 mol O₂ servono 10 mol di H₂. La massa molare di H₂ vale 2 g/mol, quindi m(H₂) = 10 × 2 = 20 g.
Mol con volume: volume di O₂ per ottenere 1 mol di H₂O a CNTP
Reazione bilanciata: 2 H₂ + O₂ → 2 H₂O. Per 2 mol di H₂O servono 1 mol di O₂; per 1 mol di H₂O serve 1/2 mol di O₂. A CNTP il volume molare è 22,4 L/mol, dunque il volume richiesto è 11,2 L di O₂.
Da massa a massa: ammoniaca da 14 kg di azoto
Reazione: N₂ + 3 H₂ → 2 NH₃. Dati: 14 kg di N₂; incognita: massa di NH₃. Masse molari: MM(N₂) = 28 g/mol, MM(NH₃) = 17 g/mol. La proporzione in moli è 1 mol N₂ → 2 mol NH₃, quindi in massa 28 g N₂ → 2 × 17 = 34 g NH₃. Con 14 000 g N₂ la proporzione diventa 28 : 34 = 14 000 : X, da cui X = 17 000 g; cioè 17 kg di NH₃.
Combustione del propano: ossigeno richiesto per 22 kg di C₃H₈
Reazione bilanciata: C₃H₈ + 5 O₂ → 3 CO₂ + 4 H₂O. MM(C₃H₈) = 44 g/mol, MM(O₂) = 32 g/mol. Dalla reazione, 1 mol di propano richiede 5 mol di O₂ cioè 44 g C₃H₈ richiedono 5 × 32 = 160 g O₂. Per 22 000 g C₃H₈ vale 44 : 160 = 22 000 : X, da cui X = 22 000 × 160 / 44 = 80 000 g. Servono dunque 80 kg di O₂.
CO e CO₂: tabella di proporzioni e reagente limitante
Formazione di CO₂: 2 CO + O₂ → 2 CO₂. Interpretiamo l’equazione in vari modi: in moli 2:1:2; in massa (MM: CO = 28 g/mol, O₂ = 32 g/mol, CO₂ = 44 g/mol) 2 × 28 g : 32 g : 2 × 44 g, cioè 56 g CO reagiscono con 32 g O₂ per dare 88 g CO₂. Se disponi di 80 g di CO e 32 g di O₂, reagiranno solo 58 g di CO con 32 g di O₂. CO è in eccesso e O₂ è il reagente limitante; avanzeranno 80 − 58 = 22 g di CO.
Combustione del carbone antracite: massa di CO₂ emessa
Reazione: C + O₂ → CO₂. In un carbone antracite con 90% di carbonio, su 100 g di campione si considerano 90 g di C. Con 12 g C si ottengono 44 g CO₂, quindi X = 90 × 44 / 12 = 330 g di CO₂ emessi.
Ruggine su ferro: massa di Fe₂O₃·H₂O prodotta da 2,8 g di Fe
Consideriamo l’ossidazione del ferro che porta a un ossido idrato, la cosiddetta ruggine: Fe₂O₃·H₂O con MM = 178 g/mol. Con metà di un chiodo da 5,6 g, cioè 2,8 g di Fe, e la corrispondenza stechiometrica 2 Fe (2 × 56 g) → 1 Fe₂O₃·H₂O (178 g), si ottiene X = 2,8 × 178 / (2 × 56) = 4,45 g di ruggine.
Rigenerare argento da Ag₂S con alluminio
Reazione bilanciata: 3 Ag₂S + 2 Al → Al₂S₃ + 6 Ag. MM(Ag₂S) = 248 g/mol; MM(Ag) = 108 g/mol. La proporzione è 3 mol Ag₂S → 6 mol Ag, cioè 3 × 248 g → 6 × 108 g. Con 2,48 g di Ag₂S: X = 2,48 × 6 × 108 / (3 × 248) = 2,16 g di Ag rigenerato.
Eliminare etilene con permanganato: massa minima di KMnO₄
Reazione semplificata e bilanciata: 2 KMnO₄ + 3 C₂H₄ + 4 H₂O → 2 MnO₂ + 3 HOCH₂CH₂OH + 2 KOH. MM(KMnO₄) = 158 g/mol; MM(C₂H₄) = 28 g/mol. La proporzione in massa è 2 × 158 g ↔ 3 × 28 g. Per 1,0 mg di C₂H₄, X = (2 × 158 / (3 × 28)) mg ≈ 3,8 mg di KMnO₄, senza spreco di reagente.
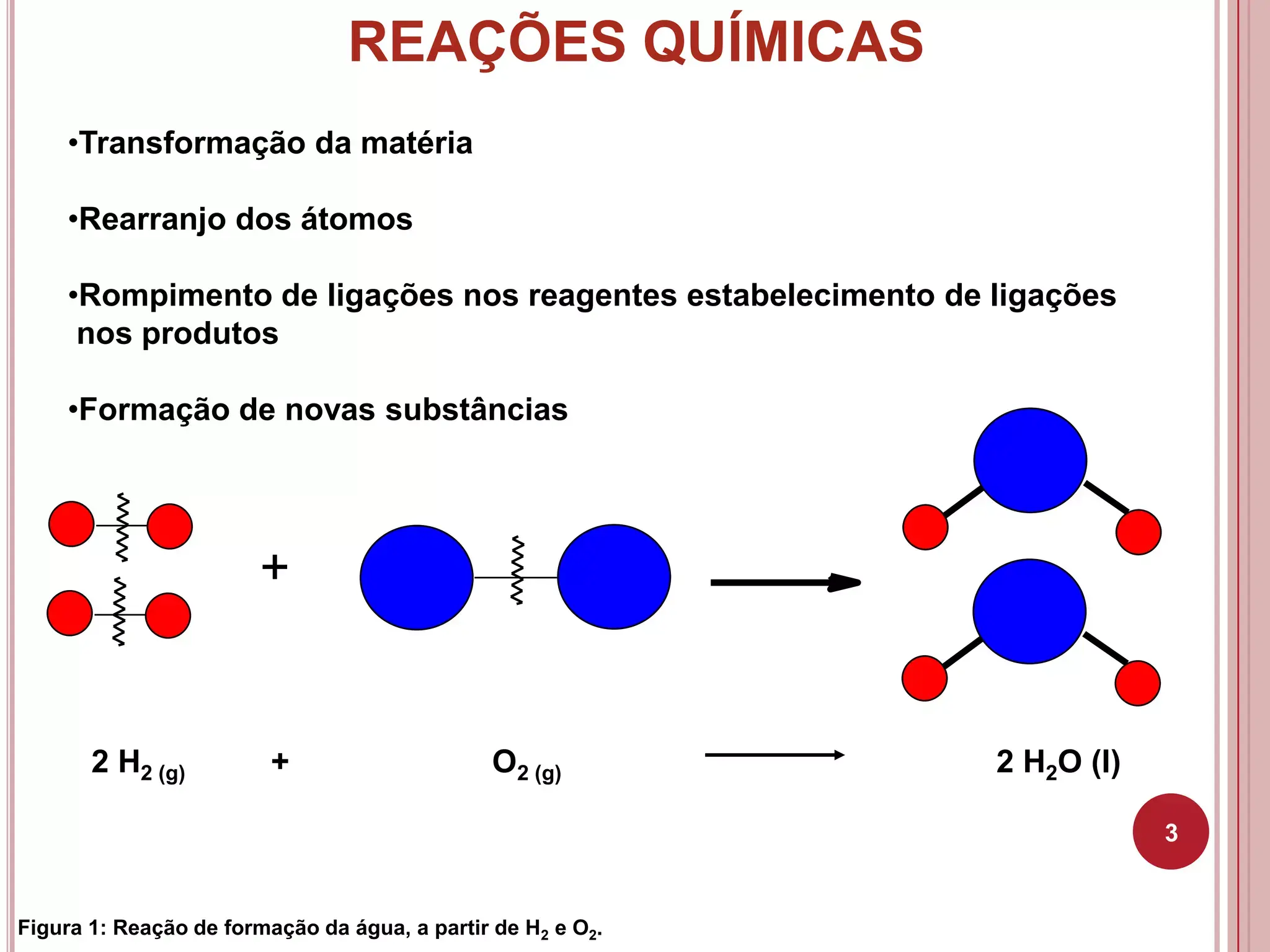
Acqua da H₂ e O₂: il senso del bilanciamento
La reazione non bilanciata H₂ + O₂ → H₂O non rispetta le quantità di atomi. Mettendo i coefficienti giusti, si ottiene 2 H₂ + O₂ → 2 H₂O. Così, su entrambi i lati, gli atomi di H sono 4 e quelli di O sono 2, rispettando la conservazione della massa.
Conversioni, grandezze e accorgimenti utili
Moli e massa molare. La massa molare è la massa in grammi di 1 mol di entità elementari (atomi, molecole, ioni) ed è numericamente uguale alla massa atomica a livello pratico. Grazie a questa grandezza, si passa da moli a grammi e viceversa in modo immediato. Per miscele e calcoli di composizione, anche la frazione molare è utile.
Numero di Avogadro. 1 mol contiene 6,02 × 10²³ particelle. Sapendo i moli, puoi contare le molecole. Per esempio, N₂ + 3 H₂ → 2 NH₃: con 4 mol di N₂ si ottengono 8 mol di NH₃, cioè 8 × 6,02 × 10²³ = 4,816 × 10²⁴ molecole di NH₃.
Volume molare dei gas. A CNTP (0 °C, 1 atm) 1 mol di gas occupa 22,4 L. Questo consente conversioni dirette tra moli e litri quando si lavora con gas ideali in tali condizioni.
Uniformare le unità. Nella regola del tre, evita di mescolare moli con masse o volumi di sostanze diverse senza conversione, perché non esiste proporzionalità universale tra mole e massa di specie differenti. Prima metti tutto in moli o tutto in grammi o tutto in litri, e solo poi calcola. Per operazioni su soluzioni è fondamentale la procedura di diluizione.
Regola del MACHO nel bilanciamento. Bilanciare ordinatamente Metalli, Ametalli, Carbonio, Idrogeno e infine Ossigeno aiuta a convergere più rapidamente alla soluzione con il metodo per tentativi, risparmiando tempo ed errori.
Altri esercizi rapidi, passo per passo
1) Calcolare i moli di NH₃ da 5 mol di N₂ (H₂ in eccesso). N₂ + 3 H₂ → 2 NH₃. Rapporto 1:2, quindi 5 → 10 mol di NH₃. Se servisse la massa, con MM(NH₃) = 17 g/mol, m = 10 × 17 = 170 g di NH₃.
2) Volume di NH₃ a CNTP da 140 g di N₂. N₂ + 3 H₂ → 2 NH₃. 28 g N₂ danno 2 mol NH₃ cioè 2 × 22,4 = 44,8 L. Per 140 g di N₂: X = 140 × 44,8 / 28 = 224 L di NH₃.
3) Neutralizzazione H₂SO₄ con NaOH. Reazione: H₂SO₄ + 2 NaOH → Na₂SO₄ + 2 H₂O. Se 25 mL di acido sono neutralizzati da 22,50 mL di NaOH 0,10 mol/L, le moli di base sono 0,02250 L × 0,10 = 0,00225 mol NaOH. Dal rapporto 1:2, le moli di acido sono 0,00225 / 2 = 0,001125 mol H₂SO₄. La concentrazione dell’acido risulta 0,001125 mol / 0,025 L = 0,045 mol/L.
4) Termite: Fe₂O₃ + 2 Al → Al₂O₃ + 2 Fe. Con 85 g di Fe₂O₃, MM(Fe₂O₃) ≈ 160 g/mol. I passaggi di conversione danno circa 28,69 g di Al necessari, usando MM(Al) = 27 g/mol e il rapporto 2 mol Al per 1 mol Fe₂O₃.
5) Ossidazione del ferro e conteggio molecolare. Dal rapporto stechiometrico nella reazione scelta, è sempre possibile passare da moli a numero di particelle usando Avogadro, utile in esercizi su resa teorica e resa reale.
Applicazioni: laboratorio, industria e vita quotidiana
Nell’industria chimica la stechiometria guida la pianificazione di lotti e campagne produttive: determina la materia prima necessaria, stima le masse dei prodotti e riduce gli sprechi. È centrale anche nel calcolo di rese teoriche e reali, fondamentale per la valutazione economica dei processi.
Nell’industria farmaceutica permette di impostare ricette e scalare sintesi di principi attivi e formulazioni, controllando le proporzioni tra composto attivo ed eccipienti per assicurare efficacia e sicurezza del medicinale.
Nell’alimentare è utile nell’ottimizzazione di processi come fermentazioni e cotture, in cui la relazione massa–massa tra ingredienti determina consistenza e resa; in modo analogo, nelle bevande calcola concentrazioni e rapporti tra componenti a livello industriale.
Nell’ambiente si calcolano emissioni, bilanci di massa e consumi di ossigeno in processi naturali e impiantistici, con applicazioni che vanno dal controllo dell’aria fino al trattamento delle acque. Anche la fotosintesi e la respirazione possono essere descritte stechiometricamente per modellare scambi di CO₂ e O₂.
Nella didattica e negli esami la stechiometria è un tema ricorrente nei test d’ingresso e nei concorsi. In Brasile, per esempio, è uno dei nuclei più battuti nelle prove di vestibular e nell’ENEM, poiché riassume linguaggi diversi: formule, tabelle, grafici, proporzioni matematiche e simbolismo chimico.
Consigli pratici per non sbagliare
1) Bilancia prima di tutto. Ogni calcolo parte da una reazione bilanciata: senza questo, i rapporti sono falsati e i risultati non hanno senso chimico.
2) Mantieni coerenza di unità. Se lavori in massa, porta ogni quantità in grammi; se lavori in moli, converti tutto in moli; se lavori in volume di gas a CNTP, usa tutti i volumi. Mescolare unità eterogenee è la fonte più comune di errori.
3) Identifica il reagente limitante. Quando hai entrambi i reagenti con quantità finite, controlla chi si esaurisce per primo: determina la quantità massima di prodotto ottenibile e quanta sostanza resterà in eccesso.
4) Annota sempre le masse molari. Verifica MM da una tavola periodica affidabile. Un numero sbagliato si propaga in tutto l’esercizio; essere scrupolosi qui fa risparmiare tempo dopo.
5) Pensa in proporzioni. La regola del tre è la tua migliore amica: una volta allineati i rapporti di reazione e uniformate le unità, risolvere diventa sistematico e molto veloce.
La stechiometria è l’arte di far di conto in chimica: dalle leggi di Lavoisier e Proust alla pratica quotidiana dei bilanciamenti e delle proporzioni, consente di prevedere, dimensionare e ottimizzare reazioni ed impianti. Con esempi come la sintesi dell’ammoniaca, la combustione, l’ossidazione del ferro o l’uso del permanganato per abbattere l’etilene, emerge come una competenza trasversale che unisce teoria e applicazioni concrete, dal banco scuola alle più disparate industrie.