A cinética química é o estudo da velocidade com que as reações químicas ocorrem e dos fatores que influenciam essa velocidade. Neste contexto, é fundamental compreender a ordem de reação, que descreve como a concentração dos reagentes afeta a velocidade da reação. Além disso, a cinética química tem diversas aplicações práticas, como na fabricação de medicamentos, na produção de alimentos e na otimização de processos industriais. Neste artigo, exploraremos os principais conceitos da cinética química, seus fatores e a importância de seu estudo para diferentes áreas da química e da indústria.
Principais aplicações da cinética química: conheça os usos dessa área da química.
A cinética química é uma área da química que estuda a velocidade das reações químicas e os fatores que influenciam esse processo. Ela é de extrema importância em diversas aplicações práticas, desde a produção de medicamentos até a fabricação de alimentos. Vamos conhecer algumas das principais aplicações da cinética química.
Uma das aplicações mais importantes da cinética química está na indústria farmacêutica. Ao estudar a velocidade das reações envolvidas na síntese de medicamentos, os cientistas podem otimizar os processos de produção, garantindo a eficácia e a segurança dos medicamentos.
Outra aplicação relevante da cinética química é na indústria de alimentos. Ao entender como as reações químicas ocorrem durante o processamento dos alimentos, é possível melhorar a qualidade dos produtos, garantindo a conservação dos nutrientes e a segurança alimentar.
A cinética química também é utilizada na área ambiental, especialmente no estudo da degradação de poluentes. Compreender a velocidade das reações que ocorrem nos processos de limpeza de águas contaminadas, por exemplo, é fundamental para o desenvolvimento de tecnologias mais eficientes de tratamento de efluentes.
Além disso, a cinética química é essencial no desenvolvimento de novos materiais, como catalisadores e polímeros. Ao controlar a velocidade das reações envolvidas na síntese desses materiais, os cientistas podem obter produtos com propriedades específicas, atendendo às demandas de diversas indústrias.
Em resumo, a cinética química desempenha um papel fundamental em diversas áreas da ciência e da indústria, contribuindo para o avanço tecnológico e o desenvolvimento sustentável. Seu estudo é essencial para compreender e controlar as reações químicas que ocorrem em nosso dia a dia.
Fatores que influenciam a velocidade das reações químicas.
A velocidade das reações químicas pode ser influenciada por diversos fatores, sendo os principais a concentração dos reagentes, a temperatura, a presença de catalisadores e a superfície de contato.
Quanto maior a concentração dos reagentes, maior será a probabilidade de colisões entre as moléculas, o que aumenta a velocidade da reação. Da mesma forma, um aumento na temperatura também aumenta a velocidade das reações, uma vez que as moléculas possuem mais energia cinética e colidem com mais intensidade.
A presença de catalisadores é outro fator importante, pois eles diminuem a energia de ativação necessária para que a reação ocorra, acelerando o processo. Além disso, a superfície de contato entre os reagentes também influencia a velocidade da reação, pois quanto maior a área de contato, maior será a chance de colisões efetivas entre as moléculas.
Portanto, é essencial compreender e considerar esses fatores ao estudar e realizar reações químicas, a fim de controlar e otimizar a velocidade das mesmas de acordo com as necessidades e aplicações desejadas.
Ordem de cada reagente e ordem total da reação: como identificar corretamente?
Na cinética química, a ordem de cada reagente e a ordem total da reação são aspectos fundamentais para compreender a velocidade com que uma reação química ocorre. Para identificar corretamente a ordem de cada reagente, é necessário analisar os dados experimentais obtidos a partir de experimentos de cinética química.
A ordem de cada reagente em uma reação química é determinada pela sua influência na velocidade da reação. Para identificar a ordem de um reagente, é preciso realizar uma série de experimentos variando a concentração desse reagente, enquanto mantém as demais constantes. A partir dos dados de velocidade obtidos, é possível determinar a relação entre a variação na concentração do reagente e a variação na velocidade da reação.
Já a ordem total da reação é a soma das ordens de cada reagente na equação da velocidade da reação. Por exemplo, se a equação da velocidade é V = k[A]^m[B]^n, onde m e n são as ordens dos reagentes A e B, respectivamente, a ordem total da reação seria m + n. Identificar corretamente a ordem total da reação é essencial para compreender como as concentrações dos reagentes afetam a velocidade da reação.
Para resumir, a ordem de cada reagente e a ordem total da reação são determinadas a partir de experimentos de cinética química, nos quais são analisadas as relações entre a concentração dos reagentes e a velocidade da reação. Essas informações são essenciais para compreender a cinética de uma reação química e podem ter aplicações importantes em diversos campos da química.
Descubra a ordem de uma reação através de simples experimentos e cálculos matemáticos.
Cinética química é o ramo da química que estuda a velocidade das reações químicas e os fatores que influenciam essa velocidade. Uma das informações mais importantes que podemos obter sobre uma reação é a sua ordem, que nos diz como a concentração dos reagentes afeta a velocidade da reação. A ordem de uma reação pode ser determinada através de simples experimentos e cálculos matemáticos.
Para descobrir a ordem de uma reação, é necessário realizar uma série de experimentos nos quais a concentração de um dos reagentes é variada enquanto as concentrações dos outros reagentes são mantidas constantes. A velocidade da reação é medida em cada experimento e, em seguida, os dados são analisados.
Os experimentos são realizados para diferentes valores da concentração do reagente e os resultados são utilizados para construir uma equação matemática que relaciona a velocidade da reação com a concentração do reagente. A ordem da reação é determinada pela análise dos dados experimentais e pela forma da equação matemática.
Uma vez que a ordem da reação é conhecida, é possível utilizar essa informação para prever como a velocidade da reação irá mudar se a concentração dos reagentes for alterada. Além disso, a ordem da reação é importante para o desenvolvimento de mecanismos de reação e para a otimização de processos químicos.
Portanto, através de simples experimentos e cálculos matemáticos, é possível descobrir a ordem de uma reação e obter informações valiosas sobre a cinética química. É importante realizar esses experimentos com cuidado e precisão para garantir resultados confiáveis e significativos.
Cinética química: fatores, ordem de reação e aplicações
Os cinética química é o estudo das velocidades de reacção. Deduzir dados experimentais ou teóricos sobre o mecanismo molecular, através de leis expressas por equações matemáticas. Os mecanismos consistem em uma série de etapas, das quais algumas são rápidas e outras lentas.
O mais lento deles é chamado de etapa de determinação da velocidade. Portanto, conhecer as espécies intermediárias e o mecanismo operacional desta etapa é muito importante em termos cinéticos. Uma visualização do que foi dito acima é supor que os reagentes estão dentro de um frasco e que, ao reagir, os produtos escapam para fora.

Finalmente, os produtos emergem livremente pela boca da garrafa, sem mais impedimentos cinéticos. Nesta perspectiva, existem garrafas de vários tamanhos e modelos. No entanto, todos eles têm um elemento em comum: um pescoço estreito, um indicador da etapa determinante da reação.
O que estuda a cinética química?
Experimentalmente, esse ramo da química estuda as variações de concentração envolvidas em uma reação química, a partir da medição de uma propriedade específica.
A cinética química é o ramo da química encarregado de estudar todas as informações que podem ser derivadas da velocidade de uma reação. Seu nome convida você a imaginar um relógio de bolso marcando a hora de um processo, não importa onde ele ocorra: em um reator, em uma nuvem, em um rio, no corpo humano, etc.
Todas as reações químicas e, portanto, todas as transformações têm aspectos termodinâmicos, de equilíbrio e cinéticos. A termodinâmica indica se uma reação é espontânea ou não; o equilíbrio de seu grau de quantificação; e a cinética, as condições que favorecem sua velocidade e os dados sobre seu mecanismo.
Muitos dos aspectos essenciais da cinética química podem ser observados na vida cotidiana: na geladeira, que congela os alimentos para reduzir sua decomposição, congelando a água que faz parte deles. Além disso, na maturação dos vinhos, cujo envelhecimento lhe confere sabores agradáveis.
No entanto, “o tempo das moléculas” é muito diferente em suas pequenas escalas e varia muito de acordo com muitos fatores (número e tipos de ligações, tamanhos, estados da matéria, etc.).
Como o tempo é vida e também é dinheiro, é muito importante saber quais variáveis permitem que uma reação química prossiga o mais rápido possível. No entanto, às vezes é desejado o oposto: que a reação ocorra muito lentamente, principalmente se for exotérmica e houver riscos de explosão.
Quais são essas variáveis? Alguns são físicos, como a que pressão ou temperatura um reator ou sistema deve ter; e outros são químicos, como o tipo de solvente, pH, salinidade, estrutura molecular, etc.
No entanto, antes de encontrar essas variáveis, você deve primeiro estudar a cinética da presente reação.
Como Através da variação da concentração, que pode ser seguida se uma propriedade específica proporcional à primeira for quantificada. Ao longo da história, os métodos tornaram-se mais sofisticados, permitindo medições mais precisas e com intervalos cada vez menores.
Velocidade de reação
Para determinar a velocidade de uma reação química, é necessário saber como a concentração varia ao longo do tempo de qualquer uma das espécies envolvidas. Essa velocidade depende em grande parte de muitos fatores, mas o mais importante é que é mensurável para as reações que ocorrem “lentamente”.
Aqui, a palavra “lentamente” é relativa e é definida para tudo o que pode ser medido com as técnicas instrumentais disponíveis. Se, por exemplo, a reação for muito mais rápida que a capacidade de medição do equipamento, não será quantitativa nem sua cinética poderá ser estudada.
Então, a taxa de reação é determinada no limiar de qualquer processo antes de atingir o equilíbrio. Porque Porque em equilíbrio a velocidade da reação direta (formação de produtos) e a velocidade da reação inversa (formação de reagentes) são as mesmas.
Controlando as variáveis que atuam no sistema e, consequentemente, sua cinética ou a velocidade da reação, as condições ideais podem ser escolhidas para gerar uma certa quantidade de produto no tempo mais desejado e seguro.
Por outro lado, esse conhecimento revela o mecanismo molecular, que é valioso ao aumentar o desempenho de uma reação.
Definição de
Velocidade é a mudança de magnitude em função do tempo. Para esses estudos, o interesse reside em determinar a variação da concentração conforme as horas, minutos passam; o nano, pico ou até femtossegundos (10 -15 s).
Pode ter muitas unidades, mas a mais simples e mais fácil de todas é M · s -1 , ou o que é igual a mol / L · s. Independentemente de suas unidades, você deve sempre ter um valor positivo, pois é uma quantidade física (como dimensões ou massa).
No entanto, por acordo, as taxas de desaparecimento de um reagente têm um sinal negativo e as de aparência de um produto, um sinal positivo.
Mas se os reagentes e produtos têm suas próprias velocidades, como determinar a velocidade da reação geral? A resposta está nos coeficientes estequiométricos.
Equação geral
A seguinte equação química expressa a reação de A e B para formar C e D:
a A + b B => c C + d D
As concentrações molares são geralmente expressas entre colchetes, de modo que, por exemplo, a concentração da espécie A seja escrita como [A]. Assim, a taxa de reação para cada uma das espécies químicas envolvidas é:
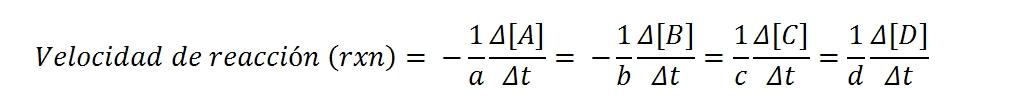
De acordo com a equação matemática, existem quatro rotas para atingir a velocidade da reação: a variação da concentração de qualquer um dos reagentes (A ou B) ou dos produtos (C ou D) é medida.
Então, com um desses valores e seu coeficiente estequiométrico correto, ele é dividido por este e obtém a taxa de reação rxn.
Como a taxa de reação é de magnitude positiva, o sinal negativo multiplica os valores de velocidade negativos dos reagentes; por esta razão, os coeficientes de um e b são multiplicados por (-1).
Por exemplo, se a taxa de desaparecimento de A for – (5M / s) e seu coeficiente estequiométrico a for 2, a taxa rxn será igual a 2,5M / s ((-1/2) x 5).
Exemplo de sobremesa

Se o produto fosse uma sobremesa, os ingredientes por analogia seriam os reagentes; e a equação química, a receita:
7 Cookies + 3Brownies + 1 Sorvete => 1 Sobremesa
E as velocidades de cada um dos ingredientes doces e da mesma sobremesa são:

Assim, a velocidade com que a sobremesa é feita pode ser determinada com a variação de biscoitos, brownies, sorvetes ou o todo; dividindo-o em seguida entre seus coeficientes estequiométricos (7, 3, 1 e 1). No entanto, uma das rotas pode ser mais fácil que a outra.
Por exemplo, se você medir como a [Sobremesa] aumenta em diferentes intervalos de tempo, essas medidas podem ser complicadas.
Por outro lado, pode ser mais conveniente e prático medir [Cookies], devido ao seu número ou a algumas de suas propriedades que facilitam a determinação de sua concentração do que a de brownies ou sorvetes.
Como determinar
Dada a reação simples A => B, se A, por exemplo, em solução aquosa, exibir uma coloração verde, isso depende de sua concentração. Assim, quando A se torna B, a cor verde desaparece e, se esse desaparecimento for quantificado, uma curva de [A] vs t pode ser obtida.
Por outro lado, se B é uma espécie ácida, o pH da solução cairá para valores abaixo de 7. Assim, a partir da diminuição do pH, [B] é obtido e, consecutivamente, o gráfico [B] vs t. Sobrepondo os dois gráficos, é possível ver algo como o seguinte:
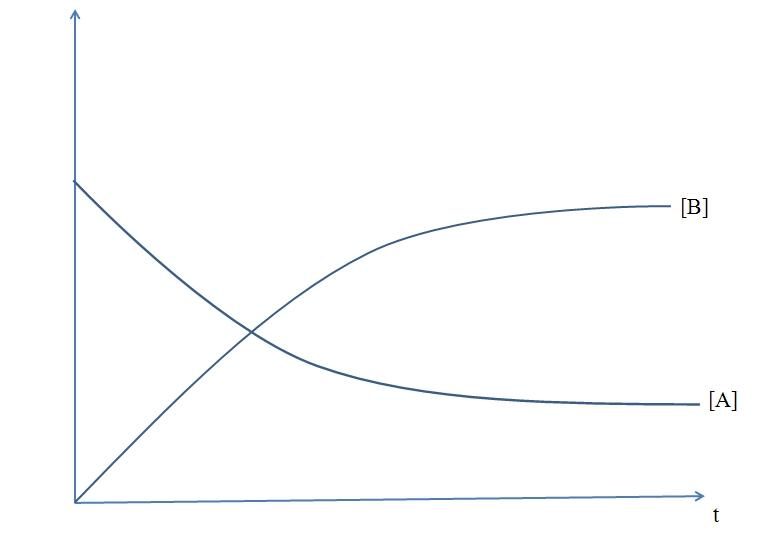
O gráfico mostra como [A] diminui com o tempo, porque é consumido, e como a curva [B] aumenta com uma inclinação positiva, porque é o produto.
Também é apreciado que [A] tenda a zero (se não houver equilíbrio) e que [B] atinja um valor máximo governado por estequiometria e se a reação estiver completa (todo A é consumido).
A taxa de reação de A e B é a linha tangente em qualquer uma dessas curvas; Em outras palavras, a derivada.
Fatores que afetam a taxa de reação
Natureza das espécies químicas
Se todas as reações químicas fossem instantâneas, não haveria estudos cinéticos. Muitos têm velocidades tão altas que não podem ser medidas; isto é, eles não são mensuráveis.
Assim, as reações entre os íons são geralmente muito rápidas e completas (com um rendimento em torno de 100%). Por outro lado, aqueles que envolvem compostos orgânicos requerem algum tempo. Uma reação do primeiro tipo é:
H 2 SO 4 + 2 NaOH => Na 2 SO 4 + 2H 2 O
Fortes interações eletrostáticas entre os íons favorecem a rápida formação de água e sulfato de sódio. Em vez disso, uma reação do segundo tipo é, por exemplo, a esterificação do ácido acético:
CH 3 COOH + CH 3 CH 2 OH => CH 3 COOCH 2 CH 3 + H 2 O
Embora a água também se forme, a reação não é instantânea; mesmo em condições favoráveis, várias horas passam para serem concluídas.
No entanto, outras variáveis têm maior impacto na velocidade da reação: concentração dos reagentes, temperatura, pressão e presença de catalisadores.
Concentração de reagente

Na cinética química, o espaço em estudo, separado do infinito, é chamado de sistema. Por exemplo, um reator, um copo, um balão, uma nuvem, uma estrela etc. pode ser considerado como o sistema em estudo.
Assim, dentro do sistema, as moléculas não são estáticas, mas “viajam” para todos os cantos. Em alguns desses movimentos, ele colide com outra molécula para saltar ou originar produtos.
Então, o número de colisões é proporcional à concentração dos reagentes. A imagem acima ilustra como o sistema muda de baixas para altas concentrações.
Além disso, enquanto houver mais colisões, a taxa de reação será maior, à medida que as chances de duas moléculas reagirem aumentar.
Se os reagentes forem gasosos, a variável pressão será tratada e relacionada à concentração de gás, assumindo uma das muitas equações existentes (como o gás ideal); ou também, o volume do sistema é reduzido para aumentar as chances de as moléculas gasosas colidirem.
Temperatura
Embora o número de colisões aumente, nem todas as moléculas têm a energia necessária para superar a energia de ativação do processo.
É aqui que a temperatura desempenha um papel importante: ela cumpre a função de acelerar termicamente as moléculas para que colidam com mais energia.
Assim, geralmente a taxa de reação dobra para cada aumento de 10 ° C na temperatura do sistema. No entanto, para todas as reações nem sempre é o caso. Como prever esse aumento? A equação de Arrhenius responde à pergunta:
d (lnK) / dT = E / (RT 2 )
K é a constante de velocidade na temperatura T, R é a constante de gás e E é a energia de ativação. Essa energia é indicativa da barreira energética que os reagentes devem reagir para reagir.
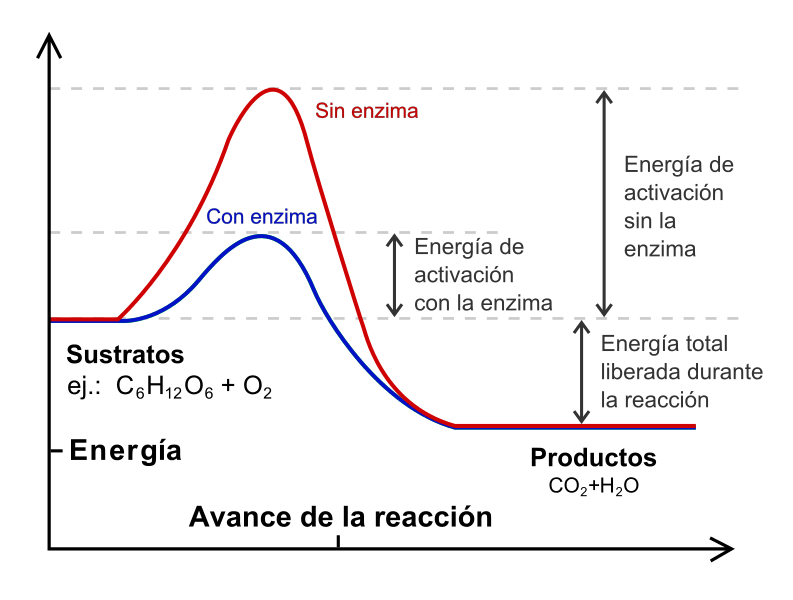
Para realizar um estudo cinético, é necessário manter a temperatura constante e sem catalisadores. Quais são os catalisadores? São espécies externas envolvidas na reação, mas não consumidas, e que diminuem a energia de ativação.
O conceito de catálise para a reação de glicose com oxigênio é ilustrado na imagem acima. A linha vermelha representa a energia de ativação sem a enzima (catalisador biológico), enquanto que com isso a linha azul mostra uma diminuição na energia de ativação.
Ordem de reação na cinética química
Em uma equação química, os índices estequiométricos, relacionados ao mecanismo da reação, não são iguais aos índices da ordem da reação. As reações químicas geralmente têm ordens de primeira ou segunda ordem, raramente de terceira ordem ou superior.
A que se deve? As colisões de três moléculas energizadas são improváveis, e mais ainda são colisões quádruplas ou quíntuplas, onde a probabilidade é infinitesimal. Ordens de reação fracionárias também são possíveis. Por exemplo:
NH 4 Cl <=> NH 3 + HCl
A reação é de primeira ordem em uma direção (da esquerda para a direita) e de segunda ordem na outra (da direita para a esquerda) se for considerada um equilíbrio. Enquanto o saldo a seguir é de segunda ordem nos dois sentidos:
2HI <=> H 2 + I 2
Molecularidade e ordem de reação são as mesmas? Não. Molecularidade é o número de moléculas que reagem para dar origem a produtos, e a ordem da reação global é a mesma ordem dos reagentes envolvidos na etapa de determinação da taxa.
2KMnO 4 + 10KI + 8H 2 SO 4 => 2MnSO 4 + 5I 2 + 6K 2 SO 4 + 8H 2 O
Essa reação, apesar de ter altos índices estequiométricos (molecularidade), é na verdade uma reação de segunda ordem. Em outras palavras, a etapa de determinação da velocidade é de segunda ordem.
Reações de ordem zero
Eles ocorrem no caso de reações heterogêneas. Por exemplo: entre um líquido e um sólido. Assim, a taxa é independente das concentrações de reagente.
Da mesma forma, se um reagente tem uma ordem de reação igual a zero, significa que ele não participa da etapa de determinação da velocidade, mas nas corredeiras.
Reação de primeira ordem
A => B
Uma reação de primeira ordem é governada pela seguinte lei de velocidade:
V = k [A]
Se a concentração de A dobrar, a taxa de reação V também aumentará. Portanto, a taxa é proporcional à concentração do reagente na etapa de determinação da reação.
Reação de segunda ordem
2A => B
A + B => C
Duas espécies estão envolvidas nesse tipo de reação, como nas duas equações químicas que acabamos de escrever. As leis da velocidade das reações são:
V = k [A] 2
V = k [A] [B]
Na primeira, a taxa de reação é proporcional ao quadrado da concentração de A, enquanto na segunda ocorre o mesmo que nas reações de primeira ordem: a taxa é diretamente proporcional às concentrações de A e B.
Ordem de reação vs. molecularidade
De acordo com o exemplo anterior, os coeficientes estequiométricos podem ou não corresponder às ordens da reação.
No entanto, isso acontece para reações elementares, que determinam o mecanismo molecular de qualquer etapa de uma reação. Nessas reações, os coeficientes são iguais ao número de moléculas participantes.
Por exemplo, uma molécula de A reage com uma molécula de B para formar uma molécula de C. Aqui a molecularidade é 1 para os reagentes e, em seguida, na expressão da lei da velocidade, coincidem com as ordens de reação.
Segue-se que a molecularidade deve sempre ser um número inteiro e, probabilisticamente, menor que quatro.
Porque Porque na passagem de um mecanismo é muito improvável que quatro m
léculas participem ao mesmo tempo; dois deles poderiam reagir primeiro e, em seguida, os dois restantes reagiriam com este produto.
Matematicamente, essa é uma das principais diferenças entre ordens de reação e molecularidade: uma ordem de reação pode assumir valores fracionários (1/2, 5/2, etc.).
Isso ocorre porque o primeiro reflete apenas como a concentração das espécies afeta a velocidade, mas não como suas moléculas intervêm no processo.
Aplicações
– Permite determinar o tempo que um medicamento permanece no organismo antes de sua metabolização completa. Da mesma forma, graças aos estudos cinéticos, a catálise enzimática pode ser seguida como métodos ecológicos em comparação com outros catalisadores com impactos ambientais negativos; ou também para ser usado em inúmeros processos industriais.
– Na indústria automotiva, especificamente nos motores, onde as reações eletroquímicas devem ser realizadas rapidamente para o veículo dar partida. Também nas suas saídas de escape, que têm conversores catalíticos prejudiciais para transformar os gases de CO, NO e NO x no CO 2 , H 2 O, N 2 e O 2 para o tempo óptimo.
2NaN 3 (s) = 2Na (s) + 3N 2 (g)
-É a reação por que os airbags, os ‘airbags’, são inflados quando os veículos colidem. Quando os pneus freiam abruptamente, um detector detona eletricamente a azida de sódio, NaN 3 . Este reagente “explode” liberando N 2 , que ocupa todo o volume da bolsa rapidamente.
O sódio metálico então reage com outros componentes para neutralizá-lo, porque em seu estado puro é venenoso.
Referências
- Walter J. Moore (1963). Química Física Em cinética química . Quarta edição, Longmans.
- Ira N. Levine. (2009). Princípios de físico-química. Sexta edição, página 479-540. Mc Graw Hill
- UAwiki (23 de dezembro de 2011). Colisões moleculares-en. [Figua] Recuperado em 30 de abril de 2018, de: es.m.wikipedia.org
- Glasstone (1970). Livro de química física. Em cinética química . Segunda edição D. Van Nostrand, Companhia, Inc.
- Anne Marie Helmenstine, Ph.D. (8 de março de 2017). Definição de cinética química. Retirado em 30 de abril de 2018, de: thoughtco.com
- Khan Academy (2018). Taxas de reação e leis de taxas. Retirado em 30 de abril de 2018, de: khanacademy.org
- Germán Fernández. (26 de julho de 2010). Cinética química Retirado em 30 de abril de 2018, de: quimicafisica.com