A coloração de esporos é uma técnica utilizada em microbiologia para identificar e classificar diferentes tipos de fungos. Através da coloração, é possível observar a morfologia dos esporos e suas características específicas, auxiliando na identificação das espécies. Neste processo, são utilizados corantes que se ligam às estruturas dos esporos, permitindo uma melhor visualização ao microscópio. As técnicas de coloração de esporos são fundamentais para estudos taxonômicos e epidemiológicos, além de serem úteis para a identificação de fungos patogênicos em amostras clínicas. Este método é amplamente utilizado em laboratórios de microbiologia e tem grande importância na pesquisa científica e na prática clínica.
Entenda sobre as técnicas de coloração e seus diferentes efeitos nos cabelos.
A coloração de esporos é uma técnica utilizada em laboratórios para identificar organismos microscópicos através da coloração de suas estruturas. Essa técnica é fundamental para a microbiologia, permitindo a visualização de diferentes tipos de bactérias, fungos e outros micro-organismos.
Existem diversas técnicas de coloração de esporos, sendo as mais comuns a coloração de Gram e a coloração de Ziehl-Neelsen. A coloração de Gram é utilizada para diferenciar bactérias em dois grupos principais: as bactérias Gram-positivas, que ficam azuis ou roxas, e as bactérias Gram-negativas, que ficam vermelhas ou rosas. Já a coloração de Ziehl-Neelsen é usada principalmente para identificar o Mycobacterium tuberculosis, causador da tuberculose, que se cora de vermelho.
As técnicas de coloração de esporos são essenciais para o diagnóstico de diversas doenças infecciosas, auxiliando os profissionais de saúde na identificação dos agentes causadores e no tratamento adequado. Além disso, essas técnicas são amplamente utilizadas em pesquisas científicas para estudar a morfologia e a estrutura dos micro-organismos.
Outras técnicas de coloração bacteriana: descubra as diferentes abordagens para identificação de microorganismos.
Além da coloração de esporos, existem diversas outras técnicas de coloração bacteriana que são utilizadas para a identificação de microorganismos. Uma delas é a coloração de Gram, que divide as bactérias em duas categorias principais: as Gram-positivas, que ficam coradas de violeta, e as Gram-negativas, que ficam coradas de rosa. Essa técnica é muito utilizada em laboratórios de microbiologia para diferenciar diferentes tipos de bactérias.
Outra técnica comum é a coloração de Ziehl-Neelsen, que é utilizada para identificar bactérias álcool-ácido resistentes, como o Mycobacterium tuberculosis, causador da tuberculose. Nesse método, as bactérias são coradas de vermelho brilhante e se destacam em meio a outros microorganismos.
Uma abordagem mais específica é a coloração de endósporos, que permite identificar a presença de esporos em bactérias. Essa técnica é útil para identificar a resistência de certas bactérias a condições adversas e pode auxiliar na escolha do tratamento mais adequado.
Em resumo, as diferentes técnicas de coloração bacteriana são essenciais para a identificação e classificação de microorganismos, auxiliando na escolha de tratamentos eficazes e no controle de infecções. Cada técnica possui suas particularidades e aplicações específicas, contribuindo para o avanço da microbiologia e da medicina.
Método de coloração para visualizar microrganismos em amostras: qual a técnica mais eficaz?
A coloração de esporos é uma técnica utilizada para visualizar microrganismos em amostras, permitindo a identificação e caracterização dos mesmos. Existem várias técnicas de coloração disponíveis, mas qual é a mais eficaz?
Uma das técnicas mais comuns e eficazes para a coloração de esporos é a coloração de Gram. Neste método, os microrganismos são submetidos a uma série de etapas que incluem a coloração com cristal violeta, iodeto de potássio, álcool e safranina. Isso permite diferenciar os microrganismos em bactérias Gram-positivas (que retêm a cor violeta) e bactérias Gram-negativas (que perdem a cor violeta após a etapa de álcool).
Outra técnica eficaz é a coloração de Ziehl-Neelsen, utilizada principalmente para a visualização de microrganismos álcool-ácido resistentes, como o Mycobacterium tuberculosis. Neste método, os microrganismos são corados com fucsina básica e posteriormente descorados com álcool-ácido, permitindo a identificação dos microrganismos resistentes.
Além disso, a coloração de Giemsa é amplamente utilizada para a visualização de parasitas sanguíneos, protozoários e até mesmo esporos fúngicos. Neste método, os microrganismos são corados com uma solução de Giemsa, permitindo a identificação de estruturas específicas dentro das células.
Em resumo, existem várias técnicas de coloração disponíveis para visualizar microrganismos em amostras, sendo a coloração de Gram, Ziehl-Neelsen e Giemsa algumas das mais eficazes e amplamente utilizadas.
Quais são as bactérias capazes de produzir endósporos?
As bactérias capazes de produzir endósporos são conhecidas como bactérias esporulantes. Estas bactérias possuem a capacidade de formar esporos como uma estratégia de sobrevivência em condições ambientais adversas. Alguns exemplos de bactérias esporulantes incluem Bacillus e Clostridium.
Os esporos são estruturas de resistência que permitem às bactérias sobreviverem em ambientes hostis, como altas temperaturas, falta de nutrientes e radiação UV. A formação de esporos é um processo complexo que envolve a transformação da célula bacteriana em uma forma dormente e altamente resistente.
A coloração de esporos é uma técnica utilizada para diferenciar as bactérias que produzem esporos das que não produzem. Esta técnica envolve a utilização de corantes especiais que penetram na parede do esporo e permitem a visualização sob o microscópio óptico. A coloração de esporos é muito útil em microbiologia para identificar bactérias esporulantes e estudar sua morfologia e distribuição.
Em resumo, as bactérias capazes de produzir endósporos são aquelas pertencentes aos gêneros Bacillus e Clostridium. A coloração de esporos é uma técnica importante na microbiologia para diferenciar essas bactérias e estudar suas características morfológicas e distribuição. A compreensão dos mecanismos de formação de esporos é essencial para entender a resistência dessas bactérias em ambientes desfavoráveis.
Coloração de esporos: fundamento, técnicas e usos
A coloração de esporos é a metodologia utilizada para colorir as estruturas de resistência que formam alguns géneros bacterianos quando em condições desfavoráveis; Essas estruturas correspondem a uma forma de sobrevivência.
Existem muitos gêneros que formam esporos; No entanto, os principais são Bacillus e Clostridium . Esses gêneros são considerados mais relevantes porque possuem espécies patogênicas para os seres humanos.
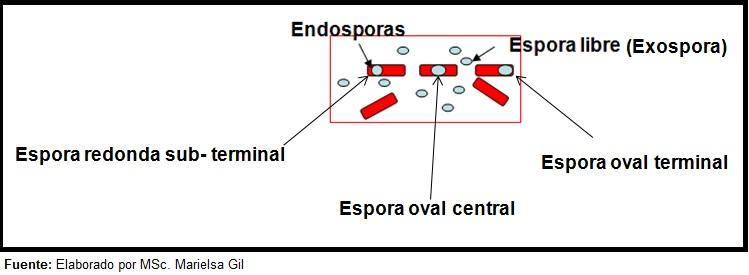
Cada bacilo pode dar origem a um esporo. No momento da coloração da preparação, o esporo pode ser encontrado dentro do bacilo (endósporo) ou fora dele (exóspora). Com técnicas convencionais de coloração de bactérias – como a coloração de Gram -, os esporos ficam incolores.
Atualmente, existem várias metodologias de coloração que são capazes de passar através da estrutura espessa do esporo para tingir. Essas metodologias são muito variadas; Isso inclui a técnica de Dorner, a mancha de Möeller e a metodologia Shaeffer-Fulton, também conhecida como Wirtz-Conklin.
De todas as técnicas mencionadas, a metodologia Shaeffer-Fulton é a mais utilizada em laboratórios de rotina. Ele deve esse nome a dois microbiologistas que criaram a coloração em 1930: Alicia Shaeffer e MacDonald Fulton. No entanto, às vezes a técnica é chamada Wirtz-Conklin em homenagem a dois bacteriologistas dos anos 1900.
Fundação
Os esporos não mancham com cores convencionais porque possuem uma parede muito grossa. A composição complexa dos esporos impede a entrada da maioria dos corantes.
Se o esporo for estudado de fora para dentro, são observadas as seguintes camadas: em primeiro lugar, o exosporium, que é a camada mais fina e externa formada pelas glicoproteínas.
Depois vem a cutícula, que fornece resistência a altas temperaturas, seguida pela casca composta por peptidoglicano. Depois, há a parede da base que protege o protoplasto.
O esporo é uma estrutura desidratada que contém 15% de cálcio e ácido dipicolínico. Portanto, a maioria das técnicas de coloração de esporos se baseia na aplicação de calor para que o corante possa penetrar na estrutura espessa.
Uma vez que o esporo é tingido, ele não pode remover o corante. Na técnica Shaeffer – Fulton, o verde malaquita entra nas células vegetativas e, quando o calor é aplicado, penetra no endosporo e também nos exosporos.
Ao lavar com água, o corante é removido da célula vegetativa. Isso ocorre porque o corante verde malaquita é um pouco básico, por isso se liga fracamente à célula vegetativa.
Por outro lado, não pode sair do esporo e, finalmente, o bacilo é contraído com safranina. Essa base é válida para o restante das técnicas, nas quais algo semelhante ocorre.
Técnicas de coloração de esporos
Para realizar a coloração de esporos, você deve ter uma cultura pura da cepa suspeita que deseja estudar.
A cultura é submetida a temperaturas extremas por 24 horas para estimular o microorganismo a esporular. Para isso, a cultura pode ser colocada em um forno a 44 ° C ou em uma geladeira (8 ° C) por 24 ou 48 horas.
Se as temperaturas mencionadas forem deixadas muito tempo, apenas exósporos serão observados, uma vez que todos os endósporos terão deixado o bacilo.
No final do tempo, algumas gotas de solução fisiológica estéril devem ser colocadas em uma lâmina limpa. Em seguida, uma pequena porção da colheita é tomada e uma propagação fina é realizada.
Em seguida, é permitido secar, fixado ao calor e corado com uma das técnicas explicadas abaixo:
Técnica de Dorner
1- Prepare em um tubo de ensaio uma suspensão concentrada do microrganismo esporulado em água destilada e adicione um volume igual de fucsina filtrada de Kinyoun filtrada.
2- Coloque o tubo em um banho com água fervente por 5 a 10 minutos.
3- Em uma lâmina limpa, misture uma gota da suspensão anterior com uma gota de solução aquosa de nigrosina a 10%, fervida e filtrada.
4- Espalhe e seque rapidamente com calor suave.
5- Examine com objetiva 100X (imersão).
Os esporos ficam vermelhos e as células bacterianas parecem quase incolores contra um fundo cinza escuro.
Técnica de Dorner modificada
1- Uma suspensão prolongada de microrganismos esporulados é feita sobre uma lâmina e fixada ao calor.
2- A amostra é coberta com uma tira de papel de filtro à qual é adicionada fucsina fenólica. O corante é aquecido por 5 a 7 minutos com a chama do queimador de Bunsen até que a liberação de vapores seja gerada. Em seguida, o papel é removido.
3- Lave a preparação com água e depois seque com papel absorvente.
4- O esfregaço é coberto com uma película fina de 10% de nigrosina, usando uma segunda lâmina para estender a nigrosina ou uma agulha.
A cor obtida pelos esporos e bactérias é a mesma descrita na técnica anterior.
Shaeffer – técnica de Fulton ou Wirtz-Conklin
1- Faça uma pasta fina com uma suspensão do microrganismo esporulado em uma lâmina e deixe aquecer.
2- Cubra a lâmina com solução aquosa verde a malaquita a 5% (um papel de filtro pode ser colocado na folha).
3 – Aqueça a chama do queimador de Bunsen até que ele libere vapores e remova a chama. Repita a operação por 6 a 10 minutos. Se a solução verde malaquita evaporar demais durante o procedimento, mais pode ser adicionado.
4- Remova o papel de filtro (se colocado) e lave com água.
5- Cubra a lâmina com safranina aquosa a 0,5% por 30 segundos (algumas variantes da técnica usam safranina aquosa a 0,1% e deixe por 3 minutos).
Com esta técnica, os esporos aparecem verdes e os bacilos vermelhos.
Tem a desvantagem de que os endósporos das culturas jovens não mancham bem, pois parecem extremamente claros ou incolores. Para evitar isso, recomenda-se o uso de culturas de incubação de 48 horas.
Técnica de Möeller
1- Cubra o esfregaço com clorofórmio por 2 minutos.
2- Descarte o clorofórmio.
3- Cubra com 5% de ácido crômico por 5 minutos.
4- Lavar com água destilada
5- A folha é coberta com carbol de fucsina-fenólico e exposta à chama do queimador de Bunsen até a emissão de vapores; então ele se retira da chama por alguns momentos. A operação é repetida até 10 minutos.
6- Lave com água.
7- Use etanol acidificado (álcool clorídrico) para branquear. Deixe por 20 ou 30 segundos.
8- Lave com água destilada.
9- Contrato cobrindo a folha com azul de metileno por 5 minutos.
10- Lave com água destilada.
11- Deixe secar e leve a amostra ao microscópio.
Os esporos parecem bacilos vermelhos e azuis. É importante não aspirar os vapores, pois são tóxicos e podem ser cancerígenos a longo prazo.
Técnica de Möeller modificada sem calor
Em 2007, Hayama e seus colaboradores criaram uma modificação da técnica de Möeller. Eles eliminaram a etapa de aquecimento do corante e a substituíram pela adição de 2 gotas do surfactante Tergitol 7 para cada 10 ml de solução de carbol de fucsina-fenólica. Os mesmos resultados foram obtidos.
Usos
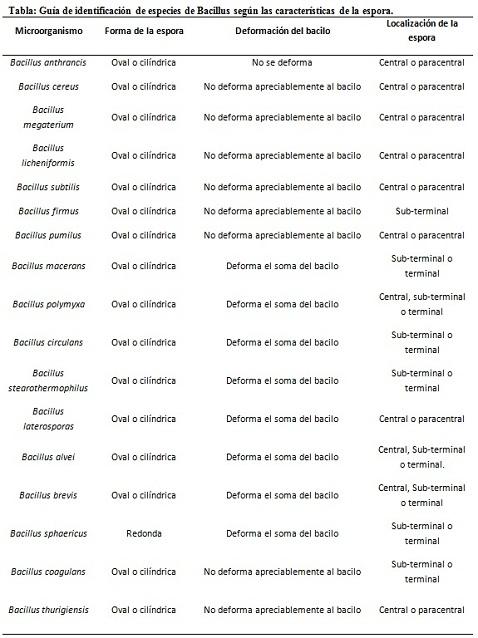
A coloração dos esporos fornece informações muito valiosas e úteis para a identificação do patógeno, uma vez que sua presença, forma, localização no bacilo e capacidade de deformar ou não a célula vegetativa são dados que podem orientar as espécies. envolvidos dentro de um determinado gênero.
Nesse contexto, vale ressaltar que os esporos podem ser redondos ou ovais, localizados no centro ou também na posição paracentral, subterrânea ou terminal.
Exemplos
– Clostridium difficile forma um esporo oval em uma posição terminal que deforma o bacilo.
– O esporo de Clostridium tertium é oval, não deforma o bacilo e está localizado no nível terminal.
– A endosfera do Clostridium tetani é terminal e deforma o bacilo, dando a aparência de uma baqueta.
– Os esporos de Clostridium botulinum , C. histolyticum , C. novy e C. septicum são subtermais redondos ou ovais e deformam o bacilo.
– O Clostridium sordelli endospora está localizado na posição central, com uma leve deformação.
Referências
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Proposta de uma técnica simplificada para a coloração de esporos bacterianos sem aplicar calor – modificação bem-sucedida do método de Moeller. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Contribuidores da Wikipedia. Mancha Moeller. Wikipedia, A Enciclopédia Livre. 3 de novembro de 2018 às 03:28 UTC. Disponível em: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Manual de Laboratório de Técnicas Microbiológicas. Departamento de Ciências Básicas da Academia de Microbiologia. Instituto Politécnico Nacional.
- «Endospora.» Wikipedia, A Enciclopédia Livre . 25 de fevereiro de 2018 às 10:20 UTC. 10 de janeiro de 2019 às 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J et al. (2006). Funcionários da comunidade autônoma da Extremadura. Agenda específica Volume IV. Editorial MAD. Sevilha-Espanha, pp 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006) Especialista em laboratório, do Serviço de Saúde da Galiza (SERGAS). Volume de agenda de assuntos específicos 2. Editorial MAD. Sevilha-Espanha, pp 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico microbiológico (5ª ed.). Argentina, Editorial Panamericana SA
- Forbes B, Sahm D, Weissfeld A. 2009. Diagnóstico microbiológico de Bailey & Scott. 12 ed. Argentina Editorial Panamericana SA