- ΔH misura il calore scambiato a pressione costante: segno positivo endotermico, negativo esotermico.
- Tipi principali: formazione, legame, combustione, cambi di stato, neutralizzazione, dissoluzione.
- Stato standard (25 °C, 1 atm) e Legge di Hess permettono calcoli coerenti con dati tabulati.
L’entalpia è uno di quei concetti di termochimica che, una volta capito, rende molto più intuitivo leggere le reazioni chimiche come scambi di energia. In termini semplici, l’entalpia (H) è una funzione di stato che permette di quantificare il calore di reazione scambiato da un sistema quando il processo avviene a pressione costante, condizione molto comune nelle trasformazioni chimiche in laboratorio e in ambiente naturale.
Sebbene qualcuno la confonda con il “calore” in senso stretto, in chimica utilizziamo quasi sempre la variazione di entalpia, ΔH, e non il valore assoluto di H. Questo perché sono le differenze energetiche tra reagenti e prodotti a dire se una reazione libera o assorbe calore. (Piccolo inciso in stile portale didattico: non fermarti ora… più avanti c’è altro contenuto!)
Argomenti trattati
- Che cos’è l’entalpia e perché è una funzione utile a pressione costante.
- ΔH e calore di reazione: segno, interpretazione e grafici endotermici ed esotermici.
- Principali tipi di entalpia: formazione, legame, combustione, cambi di stato, neutralizzazione e dissoluzione.
- Hess, stato standard e calorimetria per misurare e calcolare il calore.
- Esercizi commentati tratti da prove reali (UERJ, ENEM, Unicamp).
Che cos’è l’entalpia?
Storicamente, il concetto nasce nel XIX secolo, quando la teoria del “calorico” inizia a tramontare e la termodinamica prende forma. Josiah Willard Gibbs formalizzò l’entalpia come funzione capace di collegare in modo diretto calore e trasformazioni chimiche a pressione costante: in tali condizioni, la diminuzione o l’aumento della funzione è numericamente uguale al calore ceduto o assorbito dal sistema.
Da questo punto di vista, l’entalpia non è “calore” ma una funzione di stato che, per trasformazioni isobare, ha variazioni equivalenti al calore scambiato. Per questo, nelle reazioni chimiche, concentriamo l’attenzione su ΔH, che è la differenza tra l’entalpia dei prodotti e quella dei reagenti.
Un equivoco ricorrente è pensare che l’entalpia sia il “contenuto di calore” di una sostanza. In realtà, parlare di H assoluta ha poco senso operativo; ciò che conta è come H cambia tra inizio e fine del processo. A proposito: in molti corsi online troverai anche una video‑lezione dedicata all’argomento (contenuto incorporato), utile per fissare i passaggi chiave.
Nel linguaggio della termodinamica chimica, i processi studiati sono spesso isobari e, dunque, ΔH è un modo pratico per esprimere il calore scambiato tra sistema e ambiente quando la pressione resta costante. In questa cornice, i calcoli diventano sistematici e confrontabili.
Variazione di entalpia (ΔH) e calore di reazione
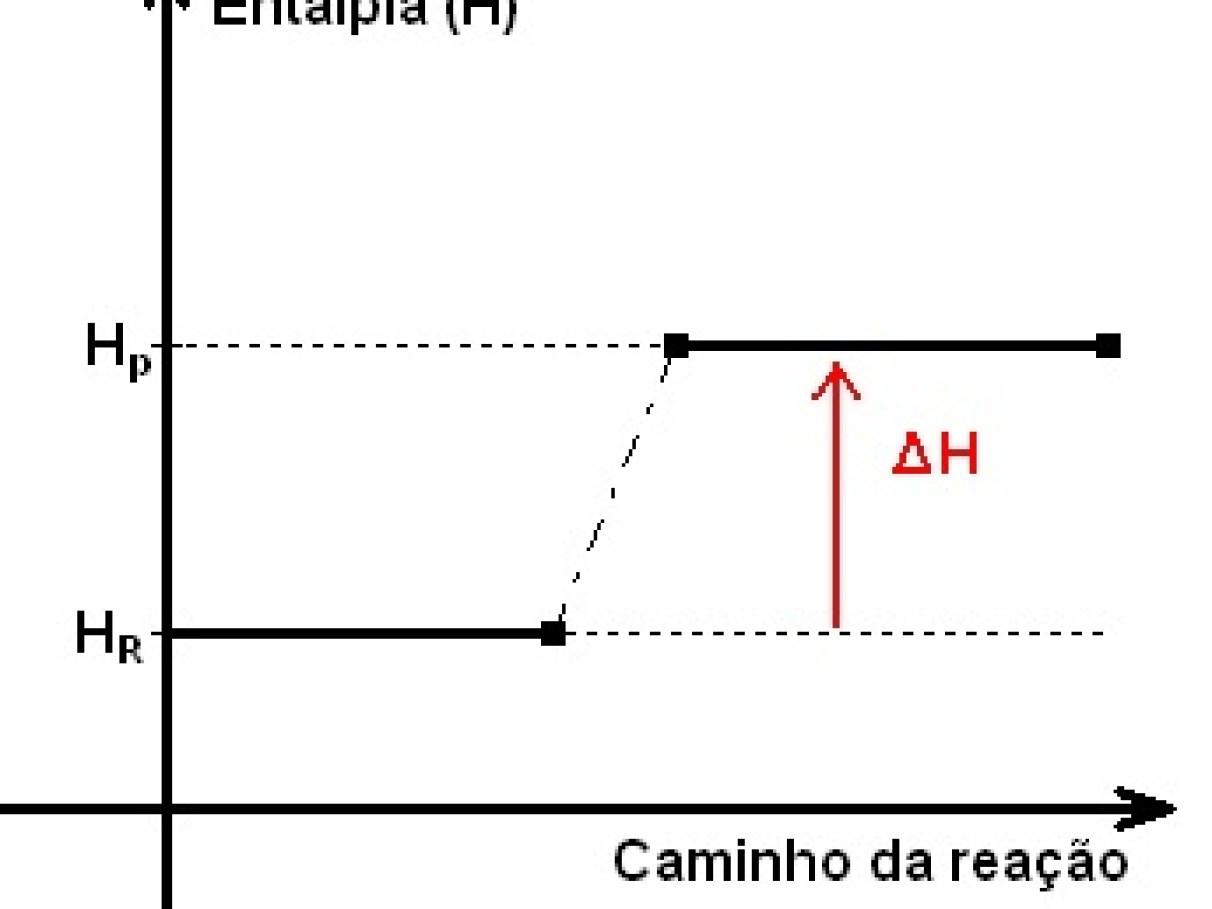
Per definizione, la variazione di entalpia è ΔH = Hfinale − Hiniziale. In chimica, identifichiamo in modo naturale “iniziale” con i reagenti e “finale” con i prodotti, per cui usiamo spesso la forma ΔH = Hprodotti − Hreagenti. Questa scelta rende immediato interpretare il segno di ΔH.
Se ΔH > 0, la reazione è endotermica: il sistema assorbe calore dall’ambiente. Al contrario, se ΔH < 0, il processo è esotermico: viene liberato calore verso l’esterno. Questa distinzione si visualizza bene nei diagrammi di entalpia: nei profili endotermici i prodotti stanno “più in alto” (H maggiore), mentre negli esotermici stanno “più in basso”.
Dal punto di vista didattico, i grafici di reazione aiutano a cogliere l’andamento energetico. Nei casi endotermici, l’area corrispondente all’energia assorbita è positiva; nei casi esotermici, l’energia “liberata” si traduce in ΔH negativo. Questa lettura è coerente con l’idea che i legami chimici si rompano e si formino con assorbimenti/rilasci di energia ben definiti.
Vale la pena ricordare che le variazioni di entalpia dei processi inversi sono uguali in modulo e opposte in segno. Se la vaporizzazione dell’acqua richiede +44 kJ/mol, la condensazione restituirà −44 kJ/mol, e lo stesso vale per fusione/solidificazione e altre trasformazioni fisiche reversibili.
Tipi di entalpia
Entalpia di formazione
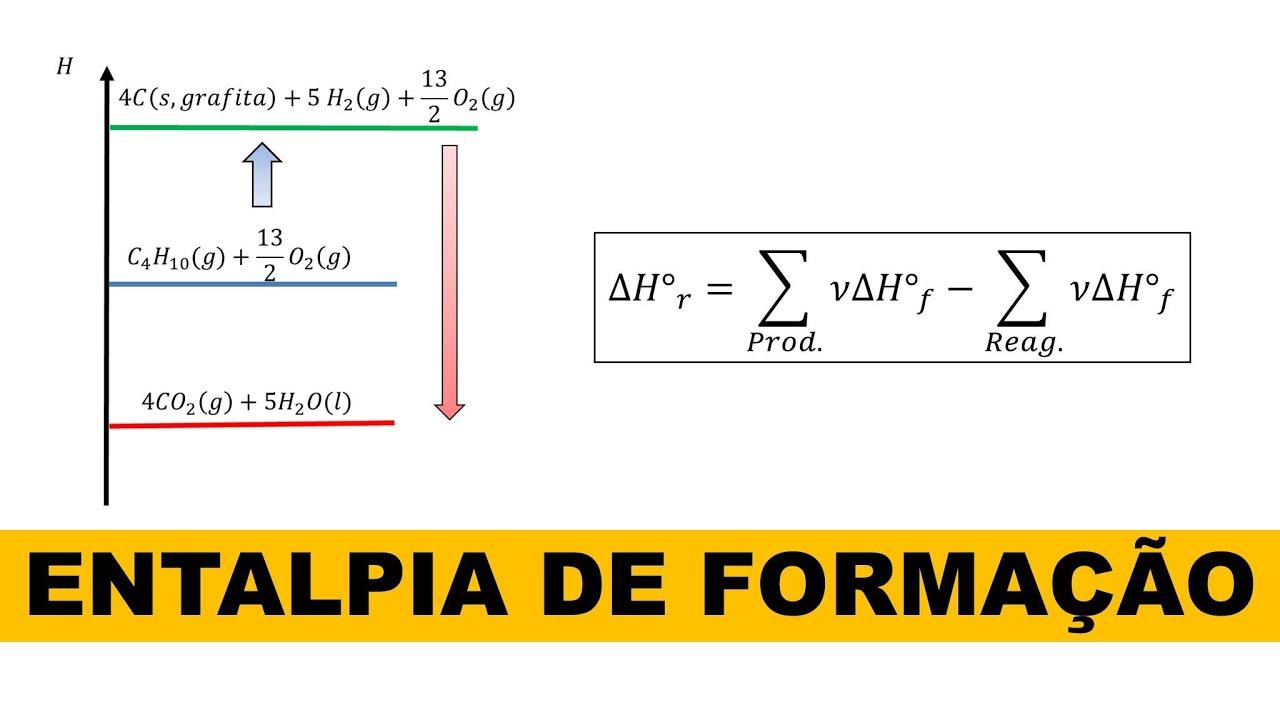
Si definisce entalpia standard di formazione la variazione di entalpia associata alla formazione di 1 mol di un composto a partire dagli elementi nei loro stati standard più stabili (di solito a 25 °C e 1 atm). Per convenzione, gli elementi nel loro stato di riferimento hanno H°f = 0, il che non implica che non possiedano energia, ma che scegliamo lo zero come riferimento comune.
Un esempio tipico è la formazione dell’acqua liquida: H2(g) + 1/2 O2(g) → H2O(l). A condizioni standard, la ΔH°f dell’acqua è circa −286 kJ/mol. Poiché gli elementi standard hanno H = 0, in pratica il valore tabulato coincide con l’entalpia del prodotto per 1 mol di sostanza formata.
Operativamente, quando sommi reazioni di formazione per ottenere una reazione complessiva, puoi ricavare ΔH della reazione sommando le ΔH°f dei prodotti e sottraendo quelle dei reagenti. Questa è la base di moltissimi calcoli termo‑chimici di laboratorio.
Entalpia di legame
La entalpia di legame quantifica l’energia necessaria per rompere 1 mol di un certo legame chimico in fase gassosa. In termini energetici, rompere legami richiede energia (processo endotermico), mentre formarli la rilascia (processo esotermico). Per questo motivo le tabelle di energie di legame spesso riportano valori in modulo, e il segno va attribuito in base al verso del processo.
Esempi numerici utili: C–H ≈ 412,9 kJ/mol, Cl–Cl ≈ 242,0 kJ/mol; per la dissociazione completa del metano in atomi gassosi, CH4(g) → C(g) + 4 H(g), si trovano valori complessivi intorno a +1651,6 kJ/mol. Questi numeri mostrano quanto “costa” energeticamente smontare i legami molecolari.
Entalpia di combustione
L’entalpia di combustione misura il calore liberato nella combustione completa di 1 mol di sostanza. Tutte le combustioni sono esotermiche, quindi ΔHc è negativa. Un esempio classico è il metano: CH4(g) + 2 O2(g) → CO2(g) + 2 H2O, con ΔH°c ≈ −889,5 kJ/mol. Per approfondire esempi pratici di questo tipo di reazioni, vedi alcuni esempi di reazioni esotermiche.
Per l’etanolo compaiono diversi valori a seconda dello stato fisico e delle convenzioni: ad esempio, per C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l) si trova ΔH ≈ −326 kcal/mol. In altre tabelle compaiono valori come etanolo (g) ≈ −372,8 kcal/mol, benzene (l) ≈ −781,0 kcal/mol, saccarosio (s) ≈ −1348,9 kcal/mol. Le differenze riflettono lo stato fisico e il riferimento standard adottato.
Entalpia di cambiamento di stato fisico
Ogni transizione di fase implica scambio di calore. La vaporizzazione dell’acqua richiede energia: H2O(l) → H2O(g) con ΔH ≈ +44 kJ/mol. La fusione del ghiaccio richiede circa +7,3 kJ/mol. Nei processi inversi (liquefazione e solidificazione) i valori sono identici in modulo ma con segno negativo.
Entalpia di neutralizzazione
Nelle reazioni acido–base, l’entalpia di neutralizzazione è la variazione di entalpia quando 1 mol di H+ reagisce con 1 mol di OH− per formare acqua. In soluzione diluita, molte neutralizzazioni forti‑forti sono quasi costanti ed esotermiche, perché si formano legami O–H rilasciando calore (il sale e l’acqua risultanti dissipano l’energia in soluzione). Per dettagli pratici, vedi l’articolo sulla reazione di neutralizzazione.
Entalpia di dissoluzione
La dissoluzione comporta rottura di interazioni nel solido e formazione di nuove interazioni soluto–solvente. Può essere endotermica o esotermica a seconda dei casi. Un dato tipico riportato è per la dissoluzione del cloruro di sodio: NaCl(s) → Na+(aq) + Cl−(aq) con ΔH ≈ −0,9 kcal/mol, leggermente esotermica. In altri casi, come alcune basi forti, l’effetto esotermico è marcato, motivo per cui si consiglia attenzione nelle pratiche di laboratorio e in ambito domestico.
Entalpia standard, Legge di Hess e confronto tra reazioni
Per confrontare dati e fare calcoli consistenti, si introducono condizioni standard (in genere 25 °C e 1 atm). In questo quadro, gli elementi nello stato più stabile hanno entalpia standard di formazione nulla, mentre ai composti si associano valori tabulati di ΔH°f. Ciò consente di ricavare ΔH di qualsiasi reazione come somma algebrica delle entalpie standard dei prodotti meno quelle dei reagenti.
La Legge di Hess afferma che la variazione complessiva di entalpia dipende solo dagli stati iniziale e finale, non dal percorso. Dunque, spezzando una reazione in passi elementari con ΔH noti, puoi sommarli (invertendo o moltiplicando quando serve) per ottenere il ΔH della reazione desiderata. Questa tecnica è estremamente potente nella risoluzione di problemi in cui ΔH non è misurabile direttamente.
In molte risorse introduttive si ribadisce l’uso delle forme sintetiche: ΔH = Hp − Hr oppure ΔH = Hf − Hi. Il segno positivo indica assorbimento di calore (endotermia), quello negativo liberazione (esotermia). Questa convenzione è universale nei testi di termo‑chimica.
Come si misura il calore: cenni di calorimetria
La termochimica studia l’assorbimento o la liberazione di calore in reazioni chimiche e trasformazioni fisiche. Per misurare quantitativamente questi scambi, si impiegano calorimetri, strumenti che consentono di quantificare la variazione di temperatura e collegarla alla quantità di calore tramite la capacità termica nota del sistema.
In pratica, la calorimetria rende operativi i concetti termodinamici: dalla misura della temperatura e dalla conoscenza delle masse e delle capacità termiche, si risale al calore scambiato e, in condizioni isobare, alla variazione di entalpia del processo. È la base sperimentale dei valori tabulati che trovi nelle tabelle di ΔH.
Processi endotermici ed esotermici, lettura dei diagrammi
Nei diagrammi di coordinata di reazione, si rappresenta l’entalpia rispetto all’avanzamento del processo. Per una reazione endotermica, i prodotti hanno H maggiore dei reagenti (ΔH > 0), mentre per una esotermica i prodotti hanno H minore (ΔH < 0). Questa visualizzazione si collega bene anche al concetto di energia di attivazione, pur essendo distinta da ΔH.
Curiosità didattica: esiste un celebre esercizio che paragona il profilo di una reazione a un disegno che ricorda un cappello o un serpente con un elefante nella pancia. Se l’inizio e la fine del profilo stanno alla stessa quota, la variazione complessiva ΔH è pressoché nulla, a prescindere da quanti prodotti si formino.
Esercizi svolti e applicazioni
Esercizio 1 (UERJ 2018). La “capacità inquinante” di un carburante è definita come il rapporto tra energia liberata e quantità di CO2 prodotta nella combustione completa. Maggiore è il rapporto, minore è la capacità inquinante (più energia per mol di CO2 emessa). Consideriamo i dati di combustione standard e calcoliamo il rapporto per alcuni idrocarburi: per un confronto con reazioni chimiche della vita quotidiana vedi esempi pratici.
Ottano: C8H18 + 25/2 O2 → 8 CO2 + 9 H2O; rapporto ≈ 5440/8 = 680
Esano: C6H14 + 19/2 O2 → 6 CO2 + 7 H2O; rapporto ≈ 4140/6 = 690
Benzene: C6H6 + 15/2 O2 → 6 CO2 + 3 H2O; rapporto ≈ 3270/6 = 545
Pentano: C5H12 + 8 O2 → 5 CO2 + 6 H2O; rapporto ≈ 3510/5 = 702
Confrontando i valori, il pentano risulta il “meno inquinante” secondo questa metrica perché produce più energia per ogni mol di CO2 emessa (rapporto più alto). Interpretativamente, per unità di CO2 rilasciata, si ottiene più lavoro utile.
Esercizio 2 (ENEM 2015). Un bio‑olio brucia con una certa ΔH1 quando si formano CO2(g) e H2O(l). Si definisce ΔH2 la variazione associata alla liquefazione di 1 g d’acqua (da vapore a liquido). Se ti chiedono la ΔH della combustione di 5 g dello stesso bio‑olio producendo CO2(g) e H2O(g), devi correggere per avere l’acqua in fase gassosa: ΔH = ΔH1 − ΔH2.
Dai dati grafici, ΔH ≈ −16,4 kJ/g per 1 g di bio‑olio. Per 5 g si ha proporzionalità diretta: 5 × (−16,4) = −82 kJ. Il risultato indica una combustione esotermica con acqua in fase vapore.
Esercizio 3 (Unicamp 2018). Un profilo di entalpia che inizia e termina alla stessa quota suggerisce ΔH circa nullo. Dalla sola forma del diagramma non si può dedurre quante specie ci siano nei prodotti; l’informazione è energetica, non stechiometrica. La risposta corretta, dunque, è che la variazione di entalpia è praticamente zero, senza deduzioni sul numero di prodotti.
Dettagli operativi e note utili
Quando applichi i calcoli con ΔH, ricorda di controllare lo stato fisico delle specie (g, l, s, aq) perché influenza i valori tabulati (ad esempio, l’acqua come prodotto in fase liquida o vapore cambia le entalpie di combustione).
Inoltre, nei problemi con legami, somma le energie per rompere tutti i legami nei reagenti e sottrai quelle rilasciate formando i legami nei prodotti. Otterrai così una stima di ΔH coerente con i valori tabulati. Questo approccio è particolarmente didattico quando mancano dati di formazione completi.
Piccola nota di colore “da portale”: in alcuni articoli divulgativi si leggono frasi tipo “Non fermarti ora… c’è altro dopo la pubblicità ;)”. Al di là dell’ironia, il filo conduttore resta invariato: appoggiarsi a ΔH per classificare e calcolare il calore di reazione in modo coerente.
Molti manuali affiancano all’entalpia anche l’entropia (S). Mentre H “misura” la parte di energia legata al calore scambiato in condizioni isobare, l’entropia quantifica il grado di dispersione/disordine. Insieme, in ambito avanzato, confluiscono nell’energia libera di Gibbs (G), ma qui ci basta ricordare che entalpia ed entropia sono grandezze distinte e complementari.
Per chi studia in modo sistematico: il quadro standard a 25 °C e 1 atm, le tabelle di ΔH°f, la Legge di Hess e la calorimetria costituiscono gli strumenti principali per stimare e verificare il calore di reazione, classificare i processi (endotermici/esotermici) e discutere l’energia associata a legami, combustioni e cambiamenti di stato.
L’entalpia è la chiave pratica per leggere l’energia in gioco nelle reazioni a pressione costante: ΔH ti dice se il sistema assorbe o cede calore; le categorie principali (formazione, legame, combustione, transizioni di fase, neutralizzazione, dissoluzione) coprono gran parte dei casi reali; gli esempi numerici ti guidano nell’uso di segni e unità. Con tabelle affidabili, Hess e un minimo di attenzione agli stati fisici, i calcoli diventano routine e gli esercizi “di gara” (UERJ, ENEM, Unicamp) si risolvono con sicurezza.
