O modelo atômico de Bohr, proposto pelo físico dinamarquês Niels Bohr em 1913, foi um avanço significativo na compreensão da estrutura dos átomos. Este modelo introduziu a ideia de que os elétrons orbitam em torno do núcleo em órbitas quantizadas, ou seja, em níveis de energia específicos. Além disso, o modelo de Bohr postulou que os elétrons podem saltar de uma órbita para outra, emitindo ou absorvendo energia na forma de fótons. Esses postulados foram fundamentais para o desenvolvimento da teoria quântica e da compreensão da estrutura dos átomos.
Características fundamentais do modelo atômico proposto por Bohr.
O modelo atômico proposto por Bohr foi uma das grandes contribuições para a compreensão da estrutura dos átomos. Suas principais características incluem a ideia de que os elétrons orbitam em torno do núcleo em camadas ou níveis de energia bem definidos. Além disso, Bohr postulou que os elétrons podem saltar de uma camada para outra, emitindo ou absorvendo energia em forma de fótons. Essas transições são responsáveis pela emissão de luz quando um átomo é excitado.
Outro aspecto importante do modelo de Bohr é a quantização dos níveis de energia dos elétrons. Isso significa que os elétrons só podem ocupar determinadas órbitas ao redor do núcleo, com valores bem definidos de energia. Esses valores são dados por números inteiros, chamados de números quânticos, que descrevem as propriedades dos elétrons em um átomo.
Em resumo, o modelo atômico de Bohr trouxe uma nova abordagem para a compreensão da estrutura dos átomos, introduzindo conceitos como órbitas quantizadas e transições de energia. Essas ideias foram fundamentais para o desenvolvimento da teoria quântica e continuam sendo essenciais para a descrição do comportamento dos átomos e moléculas.
Principais postulados do modelo atômico de Bohr: descubra aqui de forma resumida.
O modelo atômico de Bohr, proposto por Niels Bohr em 1913, foi um avanço significativo na compreensão da estrutura dos átomos. Este modelo apresenta alguns postulados importantes que ajudam a explicar o comportamento dos elétrons ao redor do núcleo atômico.
Um dos principais postulados de Bohr é que os elétrons se movem em órbitas circulares ao redor do núcleo em níveis de energia quantizados. Isso significa que os elétrons só podem ocupar determinadas órbitas, com energias específicas, e não podem estar em qualquer lugar entre essas órbitas.
Além disso, Bohr postulou que os elétrons podem saltar de uma órbita para outra, desde que absorvam ou emitam energia correspondente à diferença de energia entre as órbitas. Esse fenômeno é responsável pela emissão e absorção de luz por átomos, e é a base para a explicação dos espectros atômicos.
Outro ponto importante do modelo de Bohr é que, ao se movimentarem em órbitas estáveis, os elétrons não emitem radiação eletromagnética, o que evita que eles percam energia e caiam no núcleo. Isso ajuda a explicar a estabilidade dos átomos e a manutenção de suas estruturas.
Em resumo, os postulados do modelo atômico de Bohr, como a quantização dos níveis de energia, os saltos quânticos dos elétrons e a estabilidade das órbitas, contribuíram significativamente para o desenvolvimento da teoria atômica e para a compreensão da estrutura dos átomos.
A melhor explicação para o modelo atômico de Bohr em poucas palavras.
O modelo atômico de Bohr proposto por Niels Bohr em 1913 é baseado na ideia de que os elétrons orbitam em torno do núcleo em órbitas definidas e quantizadas. De acordo com Bohr, os elétrons só podem ocupar certas órbitas específicas, chamadas de níveis de energia. Quando um elétron salta de um nível de energia mais alto para um mais baixo, ele emite ou absorve energia na forma de fótons. Este modelo foi fundamental para a compreensão da estrutura do átomo e para explicar o espectro de emissão dos elementos químicos. Apesar de algumas limitações, o modelo de Bohr foi um marco na história da física quântica e contribuiu significativamente para o desenvolvimento da teoria atômica.
Principais vantagens do modelo de Bohr na explicação da estrutura atômica.
O modelo atômico de Bohr trouxe diversas vantagens na explicação da estrutura dos átomos. Uma das principais vantagens é a capacidade de explicar de forma satisfatória o espectro de emissão dos átomos. De acordo com o modelo de Bohr, os elétrons se movem em órbitas circulares ao redor do núcleo do átomo em níveis de energia quantizados. Quando um elétron salta de uma órbita para outra de menor energia, é emitido um fóton de luz com uma frequência específica, o que resulta em linhas espectrais bem definidas.
Outra vantagem do modelo de Bohr é a explicação da estabilidade dos átomos. Segundo o modelo, os elétrons mais próximos do núcleo ocupam os níveis de energia mais baixos, o que resulta em uma menor energia total do sistema. Isso faz com que os átomos sejam mais estáveis em seu estado fundamental, evitando colapsos ou instabilidades.
Além disso, o modelo de Bohr também foi fundamental na compreensão da transição entre estados de energia dos elétrons. Ele permitiu a previsão da energia necessária para que um elétron salte de uma órbita para outra, o que é essencial para entender fenômenos como a absorção e emissão de luz pelos átomos.
Em resumo, o modelo atômico de Bohr foi um marco na explicação da estrutura atômica, trazendo consigo vantagens significativas na compreensão do comportamento dos átomos e suas interações com a luz e outras partículas.
Modelo atômico de Bohr: características e postulados
O modelo de Bohr é uma representação do átomo proposto pelo físico dinamarquês Niels Bohr (1885-1962). O modelo afirma que o elétron viaja em órbita a uma distância fixa ao redor do núcleo atômico, descrevendo um movimento circular uniforme. As órbitas – ou níveis de energia, como ele os chamava – são de energia diferente.
Cada vez que o elétron muda sua órbita, emite ou absorve energia em quantidades fixas chamadas “quanta”. Bohr explicou o espectro da luz emitida (ou absorvida) pelo átomo de hidrogênio. Quando um elétron se move de uma órbita para outra em direção ao núcleo, ocorre uma perda de energia e a luz é emitida, com comprimento de onda e energia característicos.

Bohr numerou os níveis de energia do elétron, considerando que quanto mais próximo o elétron está do núcleo, menor é o seu estado energético. Assim, quanto mais o elétron estiver do núcleo, maior será o número do nível de energia e, portanto, o estado de energia será maior.
Características principais
As características do modelo de Bohr são importantes porque determinaram o caminho para o desenvolvimento de um modelo atômico mais completo. Os principais são:
É baseado em outros modelos e teorias da época
O modelo de Bohr foi o primeiro a incorporar a teoria quântica baseada no modelo atômico de Rutherford e em idéias retiradas do efeito fotoelétrico de Albert Einstein. De fato, Einstein e Bohr eram amigos.
Evidência experimental
De acordo com este modelo, os átomos absorvem ou emitem radiação apenas quando os elétrons saltam entre as órbitas permitidas. Os físicos alemães James Franck e Gustav Hertz obtiveram evidências experimentais desses estados em 1914.
Os elétrons existem em níveis de energia
Os elétrons circundam o núcleo e existem em certos níveis de energia, que são discretos e são descritos em números quânticos.
O valor energético desses níveis existe em função de um número n, chamado número quântico principal, que pode ser calculado com equações que serão detalhadas abaixo.
Sem energia, não há movimento do elétron

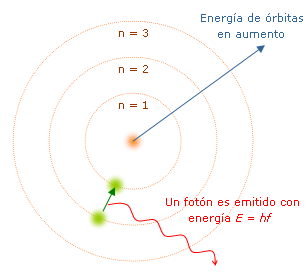
A ilustração acima mostra um elétron que faz saltos quânticos.
De acordo com esse modelo, sem energia não há movimento do elétron de um nível para outro, assim como sem energia não é possível levantar um objeto que caiu ou separar dois ímãs.
Bohr sugeriu o quantum como a energia requerida por um elétron para passar de um nível para outro. Ele também estabeleceu que o nível mais baixo de energia que um elétron ocupa é chamado de “estado fundamental”. O “estado excitado” é um estado mais instável, resultado da passagem de um elétron para um orbital de maior energia.
Número de elétrons em cada camada
Os elétrons que se encaixam em cada camada são calculados com 2n 2
Os elementos químicos que fazem parte da tabela periódica e que estão na mesma coluna têm os mesmos elétrons na última camada. O número de elecrons nas quatro primeiras camadas seria 2, 8, 18 e 32.
Elétrons giram em órbitas circulares sem irradiar energia
De acordo com o Primeiro Postulado de Bohr, os elétrons descrevem órbitas circulares ao redor do núcleo do átomo sem irradiar energia.
Órbitas permitidas
Segundo o segundo postulado de Bohr, as únicas órbitas permitidas para um elétron são aquelas para as quais o momento angular L do elétron é um múltiplo inteiro da constante de Planck. Matematicamente, é expresso assim:

Energia emitida ou absorvida em saltos
Segundo o terceiro postulado, os elétrons emitiam ou absorviam energia nos saltos de uma órbita para outra. No salto em órbita, um fóton é emitido ou absorvido, cuja energia é representada matematicamente:
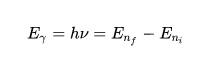
O modelo atômico de Bohr postula
Bohr deu continuidade ao modelo planetário do átomo, segundo o qual elétrons giravam em torno de um núcleo carregado positivamente, assim como planetas ao redor do Sol.
No entanto, esse modelo desafia um dos postulados da física clássica. Segundo ele, uma partícula com uma carga elétrica (como o elétron) que se move em um caminho circular deve perder energia continuamente emitindo radiação eletromagnética. Ao perder energia, o elétron teria que seguir uma espiral até cair no núcleo.
Bohr então assumiu que as leis da física clássica não são as mais apropriadas para descrever a estabilidade observada nos átomos e expôs os três postulados a seguir:
Primeiro postulado

O elétron gira em torno do núcleo em órbitas que desenham círculos, sem irradiar energia. Nessas órbitas, o momento orbital angular é constante.
Para os elétrons de um átomo, somente órbitas de certos raios são permitidas, correspondendo a certos níveis de energia definidos.
Segundo postulado

Nem todas as órbitas são possíveis. Mas uma vez que o elétron está em uma órbita permitida, ele está em um estado específico e constante de energia e não emite energia (órbita estacionária de energia).
Por exemplo, no átomo de hidrogênio, as energias permitidas para o elétron são dadas pela seguinte equação:

Nesta equação, o valor -2,18 x 10–18 é a constante de Rydberg para o átomo de hidrogênio e n = número quântico pode levar valores de 1 a ∞.
As energias do elétron de um átomo de hidrogênio que são geradas a partir da equação anterior são negativas para cada um dos valores de n. Na medida em que n aumenta, a energia é menos negativa e, portanto, aumenta.
Quando n é grande o suficiente – por exemplo, n = ∞ – a energia é zero e representa que o elétron foi liberado e o átomo ionizado. Esse estado de energia zero abriga uma energia maior que os estados com energias negativas.
Terceiro postulado
Um elétron pode mudar de uma órbita estacionária de energia para outra por emissão ou absorção de energia.
A energia emitida ou absorvida será igual à diferença de energia entre os dois estados. Essa energia E está na forma de um fóton e é dada pela seguinte equação:
E = h ν
Nesta equação, E é a energia (absorvida ou emitida), h é a constante de Planck (seu valor é 6,63 x 10-34 joule-segundos [Js]) e ν é a frequência da luz, cuja unidade é 1 / s
Diagrama dos níveis de energia dos átomos de hidrogênio
O modelo de Bohr foi capaz de explicar satisfatoriamente o espectro do átomo de hidrogênio. Por exemplo, na faixa de comprimentos de onda da luz visível, o espectro de emissão do átomo de hidrogênio é o seguinte:
Vamos ver como você pode calcular a frequência de algumas das faixas de luz observadas; por exemplo, o da cor vermelha.
Usando a primeira equação e substituindo n por 2 e 3, são obtidos os resultados mostrados no diagrama.

Quer dizer:
Para n = 2, E 2 = -5,45 x 10 -19 J
Para n = 3, E 3 = -2,42 x 10 -19 J
É então possível calcular a diferença de energia para os dois níveis:
ΔE = E 3 – E 2 = (-2,42 – (- 5,45)) x 10 – 19 = 3,43 x 10 – 19 J
De acordo com a equação explicada no terceiro postulado ΔE = h ν. Então, você pode calcular ν (frequência da luz):
ν = ΔE / h
Quer dizer:
ν = 3,43 x 10–19 J / 6,63 x 10 -34 Js
ν = 4,56 x 10 14 s -1 ou 4,56 x 10 14 Hz
Sendo λ = c / ν, e a velocidade da luz c = 3 x 10 8 m / s, o comprimento de onda é dado por:
λ = 6,565 x 10 – 7 m (656,5 nm)
Este é o valor do comprimento de onda da faixa vermelha observado no espectro das linhas de hidrogênio.
As três principais limitações do modelo Bohr
1- Adapta-se ao espectro do átomo de hidrogênio, mas não aos espectros de outros átomos.
2- As propriedades ondulantes do elétron não estão representadas na descrição deste como uma pequena partícula que gira em torno do núcleo atômico.
3- Bohr falha em explicar por que o eletromagnetismo clássico não se aplica a seu modelo. Ou seja, por que os elétrons não emitem radiação eletromagnética quando estão em órbita estacionária.
Artigos de interesse
Modelo atômico de Schrödinger .
Modelo atômico de Broglie .
Modelo atômico de Chadwick .
Modelo atômico de Heisenberg .
Modelo atômico Perrin .
Modelo atômico de Thomson .
Modelo atômico de Dalton .
Modelo atômico de Dirac Jordan .
Modelo atômico de Demócrito .
Referências
- Brown, TL (2008). Química: a ciência central. Upper Saddle River, Nova Jersey: Pearson Prentice Hall
- Eisberg, R. & Resnick, R. (2009).Física quântica de átomos, moléculas, sólidos, núcleos e partículas . Nova Iorque: Wiley
- Modelo atômico de Bohr-Sommerfeld. Recuperado de: fisquiweb.es
- Joesten, M. (1991). Mundo da química Philadelphia, Pa.: Saunders College Publishing, pp. 76-78.
- Módulo de Bohr da Átomo d’Hidrogena. Recuperado de fr.khanacademy.org
- Izlar, K. Retrospectiva no domínio: modelo de Bohr um cent ans. Recuperado de: home.cern