A notação espectral é um sistema de representação gráfica utilizado para descrever a composição de frequências de um sinal de áudio ou musical. Ela é amplamente utilizada em áreas como a música, acústica e processamento de sinais, permitindo visualizar de forma clara as diferentes frequências presentes em um sinal. A notação espectral é especialmente útil para analisar e comparar diferentes sinais sonoros, facilitando a identificação de padrões e características específicas de cada um.
Conceitos fundamentais da espectroscopia resumidos de forma clara e objetiva.
Notação espectral é uma forma de representar as propriedades da luz ou de outras ondas eletromagnéticas em função de sua frequência ou comprimento de onda. Na espectroscopia, esses conceitos são fundamentais para a análise de amostras e identificação de substâncias.
Um dos principais conceitos é o espectro eletromagnético, que abrange todas as radiações eletromagnéticas possíveis, desde as ondas de rádio até os raios gama. Cada região do espectro está associada a uma faixa de frequência ou comprimento de onda específica.
Outro conceito importante é a absorção e emissão de radiação, que ocorre quando os átomos ou moléculas absorvem ou emitem energia em forma de radiação eletromagnética. Essas interações são características de cada substância e podem ser usadas para identificação.
Além disso, a resolução espectral é a capacidade de distinguir entre diferentes componentes de um espectro. Quanto maior a resolução, mais detalhes podem ser observados, o que é essencial para a análise precisa de amostras complexas.
Em resumo, a notação espectral é uma ferramenta essencial na espectroscopia para representar e interpretar as propriedades da luz e outras ondas eletromagnéticas, auxiliando na identificação de substâncias e na análise de amostras.
Estudo da transição d-d em complexos metálicos por espectroscopia de absorção de UV-visível.
O estudo da transição d-d em complexos metálicos por espectroscopia de absorção de UV-visível é uma técnica importante na química de coordenação. Quando um complexo metálico absorve luz na região UV-visível, ocorre uma transição de elétrons entre orbitais d do metal. Essa transição é conhecida como transição d-d.
A espectroscopia de absorção de UV-visível é uma técnica que permite estudar essas transições, fornecendo informações sobre a estrutura eletrônica dos complexos metálicos. A absorção de luz na região UV-visível resulta em transições eletrônicas que são específicas para cada complexo, permitindo a identificação e caracterização dos mesmos.
A notação espectral é uma forma de representar essas transições d-d em complexos metálicos. Ela consiste em descrever as transições em termos de energia, intensidade e polarização da luz absorvida. A notação espectral também pode incluir informações sobre os estados eletrônicos envolvidos na transição, como os orbitais d do metal.
Em resumo, o estudo da transição d-d em complexos metálicos por espectroscopia de absorção de UV-visível é uma ferramenta poderosa para investigar a estrutura eletrônica desses sistemas. A notação espectral é uma forma de representar essas transições de forma concisa e informativa, facilitando a interpretação dos dados experimentais.
Tabela de elementos químicos organizados por propriedades e número atômico
A Tabela Periódica dos Elementos é uma ferramenta fundamental na química, onde os elementos químicos são organizados de acordo com suas propriedades e número atômico. Cada elemento é representado por um símbolo químico e listado em linhas horizontais chamadas períodos e em colunas verticais chamadas grupos.
Os elementos são organizados de forma crescente de acordo com seu número atômico, que representa a quantidade de prótons no núcleo de um átomo. Isso permite que os elementos com propriedades químicas semelhantes estejam agrupados juntos na tabela, facilitando o estudo e a compreensão da química.
A Tabela Periódica é uma ferramenta essencial para os químicos, pois fornece informações importantes sobre os elementos, como massa atômica, configuração eletrônica e propriedades químicas. Ela ajuda na previsão de comportamentos químicos dos elementos e na identificação de padrões na tabela.
Ao compreender a organização dos elementos na Tabela Periódica, os químicos podem realizar experimentos, desenvolver novos compostos e compreender melhor o mundo ao seu redor. Portanto, a Tabela de elementos químicos organizados por propriedades e número atômico desempenha um papel crucial na química moderna.
O que é notação espectral?
A notação espectral ou configuração eletrônica é a disposição dos elétrons nos níveis de energia ao redor do núcleo de um átomo.
Em termos de um modelo de mecânica quântica mais refinado, as camadas KQ são subdivididas em um conjunto de orbitais, cada um dos quais pode ser ocupado por não mais que um par de elétrons (Encyclopædia Britannica, 2011).
Geralmente, a configuração eletrônica é usada para descrever os orbitais de um átomo em seu estado fundamental, mas também pode ser usada para representar um átomo que foi ionizado em um cátion ou ânion, compensando a perda ou ganho de elétrons em seus respectivos orbitais.
Muitas das propriedades físicas e químicas dos elementos podem ser correlacionadas com suas configurações eletrônicas exclusivas.
Os elétrons de valência, os elétrons na camada mais externa, são o fator determinante para a química exclusiva do elemento (Configurações de elétrons e Propriedades dos átomos, SF).
Quando os elétrons na camada mais externa de um átomo recebem algum tipo de energia, eles são transferidos para camadas de energia mais alta. Assim, um elétron na camada K será transferido para a camada L, estando em um estado de maior energia.
Quando o elétron retorna ao seu estado fundamental, ele libera a energia que absorve emitindo um espectro eletromagnético (luz). Como cada átomo tem uma configuração eletrônica específica, também terá um espectro específico que será chamado espectro de absorção (ou emissão).
Por esse motivo, o termo notação espectral é usado para se referir à configuração eletrônica (Notação espectroscópica, SF).
Como determinar a notação espectral: números quânticos
Um total de quatro números quânticos é usado para descrever completamente o movimento e as trajetórias de cada elétron dentro de um átomo.
A combinação de todos os números quânticos de todos os elétrons em um átomo é descrita por uma função de onda que cumpre com a equação de Schrödinger. Cada elétron em um átomo tem um conjunto único de números quânticos.
De acordo com o princípio de exclusão de Pauli, dois elétrons não podem compartilhar a mesma combinação de quatro números quânticos.
Os números quânticos são importantes porque podem ser usados para determinar a configuração eletrônica de um átomo e a provável localização dos elétrons no átomo.
Os números quânticos também são usados para determinar outras características dos átomos, como energia de ionização e raio atômico.
Os números quânticos designam conchas, subcamadas, orbitais e giros de elétrons específicos.
Isso significa que eles descrevem completamente as características de um elétron em um átomo, ou seja, descrevem cada solução única para a equação de Schrödinger, ou a função de onda, dos elétrons em um átomo.
Há um total de quatro números quânticos: o número quântico principal (n), o número quântico do momento angular orbital (l), o número quântico magnético (ml) e o número quântico do spin do elétron (ms).
O número quântico principal, nn, descreve a energia de um elétron e a distância mais provável entre o elétron e o núcleo. Em outras palavras, refere-se ao tamanho do orbital e ao nível de energia em que um elétron é colocado.
O número de subcamadas, ou ll, descreve a forma do orbital. Também pode ser usado para determinar o número de nós angulares.
O número quântico magnético, ml, descreve os níveis de energia em uma subcamada e mais se refere à rotação do elétron, que pode ser aumentada ou reduzida (Anastasiya Kamenko, 2017).
Princípio de Aufbau
Aufbau vem da palavra alemã “Aufbauen”, que significa “construir”. Em essência, escrevendo configurações de elétrons, estamos construindo orbitais de elétrons à medida que passamos de um átomo para outro.
Ao escrevermos a configuração eletrônica de um átomo, preencheremos os orbitais em ordem crescente de número atômico.
O princípio de Aufbau se origina do princípio de exclusão de Pauli, que diz que não há dois férmions (por exemplo, elétrons) em um átomo.
Eles podem ter o mesmo conjunto de números quânticos e, portanto, precisam “acumular-se” em níveis mais altos de energia. Como os elétrons se acumulam é uma questão de configurações eletrônicas (Princípio de Aufbau, 2015).
Átomos estáveis têm tantos elétrons quanto os prótons no núcleo. Os elétrons se reúnem ao redor do núcleo em orbitais quânticos, seguindo quatro regras básicas chamadas de princípio de Aufbau.
- Não há dois elétrons no átomo que compartilham os mesmos quatro números quânticos n, l, m e s.
- Os elétrons primeiro ocuparão os orbitais do menor nível de energia.
- Os elétrons preencherão os orbitais sempre com o mesmo número de spin. Quando os orbitais estiverem cheios, começará.
- Os elétrons preencherão os orbitais pela soma dos números quânticos n e l. Orbitais com valores iguais de (n + l) serão preenchidos primeiro com os valores n mais baixos.
A segunda e quarta regras são basicamente as mesmas. Um exemplo da regra quatro seria os orbitais 2p e 3s.
Um orbital 2p é n = 2 e l = 2 e um orbital 3s é n = 3 e l = 1. (N + l) = 4 em ambos os casos, mas o orbital 2p tem a menor energia ou o menor valor n e será preenchido antes do Camada 3s
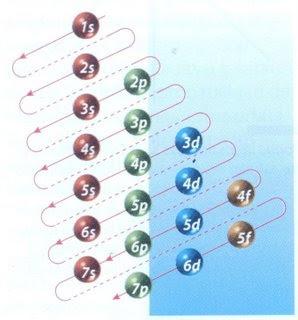
Felizmente, o diagrama de Moeller mostrado na Figura 2 pode ser usado para preencher elétrons. O gráfico é lido executando as diagonais de 1s.
A Figura 2 mostra os orbitais atômicos e as setas seguem o caminho a seguir.
Agora que se sabe que a ordem dos orbitais está preenchida, resta apenas memorizar o tamanho de cada orbital.
Os orbitais S têm 1 valor possível de ml para conter 2 elétrons
Os orbitais P têm 3 valores possíveis de ml para conter 6 elétrons
Os orbitais D têm 5 valores possíveis de ml para conter 10 elétrons
Os orbitais F têm 7 valores possíveis de ml para conter 14 elétrons
Isso é tudo o que é necessário para determinar a configuração eletrônica de um átomo estável de um elemento.
Por exemplo, considere o elemento nitrogênio. O nitrogênio tem sete prótons e, portanto, sete elétrons. O primeiro orbital a ser preenchido é o 1s. Um orbital s tem dois elétrons, então restam cinco elétrons.
O próximo orbital é o orbital 2s e contém os dois seguintes. Os três elétrons finais irão para o orbital 2p que pode conter até seis elétrons (Helmenstine, 2017).
Regras Hund
A seção Aufbau discutiu como os elétrons enchem primeiro os orbitais da energia mais baixa e depois se movem para os orbitais da energia mais alta somente depois que os orbitais da energia mais baixa estão cheios.
No entanto, há um problema com esta regra. Certamente, os orbitais 1s devem ser preenchidos antes dos orbitais 2s, porque os orbitais 1s têm um valor mais baixo de n e, portanto, uma energia mais baixa.
E os três orbitais 2p diferentes? Em que ordem eles devem ser preenchidos? A resposta a esta pergunta envolve a regra de Hund.
A regra Hund afirma que:
– Cada orbital em um subnível é ocupado individualmente antes de qualquer orbital ser duplamente ocupado.
– Todos os elétrons em orbitais ocupados individualmente têm o mesmo giro (para maximizar o giro total).
Quando os elétrons são atribuídos aos orbitais, um elétron primeiro procura encher todos os orbitais com energia semelhante (também chamados orbitais degenerados) antes de emparelhar com outro elétron em um orbital meio cheio.
Os átomos nos estados terrestres tendem a ter o maior número possível de elétrons não emparelhados. Ao visualizar esse processo, considere como os elétrons exibem o mesmo comportamento que os mesmos pólos em um ímã se entrarem em contato.
Quando elétrons carregados negativamente enchem os orbitais, eles primeiro tentam se afastar um do outro o máximo possível antes de terem que se emparelhar (Regras de Hund, 2015).
Referências
- Anastasiya Kamenko, TE (2017, 24 de março). Números de quantum . Recuperado de chem.libretexts.org.
- Princípio Aufbau . (3 de junho de 2015). Recuperado de chem.libretexts.org.
- Configurações eletrônicas e propriedades dos átomos. (SF). Recuperado de oneonta.edu.
- Encyclopædia Britannica. (7 de setembro de 2011). configuração eletrônica . Recuperado de britannica.com.
- Helmenstine, T. (2017, 7 de março). O princípio de Aufbau – estrutura eletrônica e o princípio de Aufbau. Recuperado de thoughtco.com.
- Regras de Hund . (18 de julho de 2015). Recuperado de chem.libretexts.org.
- Notação espectroscópica. (SF). Recuperado de bcs.whfreeman.com.