Existem diversas bases químicas que podem ser encontradas em casa e que desempenham papéis importantes em nossa rotina diária. Desde produtos de limpeza até medicamentos, as bases químicas estão presentes em uma variedade de itens que utilizamos em nosso lar. Neste artigo, exploraremos algumas das bases mais comuns encontradas em casa e como elas são utilizadas em diferentes contextos.
Quais são as bases comuns utilizadas diariamente?
As bases químicas são substâncias que têm um pH acima de 7 e ajudam a neutralizar ácidos. Elas podem ser encontradas em muitos produtos de uso diário em nossas casas. Alguns exemplos de bases comuns incluem:
- Sabonete: muitos sabonetes contêm bases como hidróxido de sódio, que ajudam a limpar a pele e remover a sujeira.
- Detergente: os detergentes para lavar louça e roupas muitas vezes contêm bases como carbonato de sódio, que ajudam a remover manchas e gordura.
- Produtos de limpeza: muitos produtos de limpeza doméstica contêm bases como amônia, que ajudam a desinfetar e desengordurar superfícies.
- Antiácidos: medicamentos antiácidos contêm bases como hidróxido de magnésio, que ajudam a neutralizar o ácido estomacal e aliviar a azia.
Estas são apenas algumas das bases químicas que encontramos em nossas casas no dia a dia. É importante ter em mente que, assim como os ácidos, as bases também devem ser manuseadas com cuidado para evitar acidentes. Certifique-se de seguir as instruções de uso e armazenamento dos produtos que contêm bases para garantir a segurança de todos em casa.
Três exemplos de bases e sua definição.
Nossa casa está cheia de substâncias químicas, e muitas delas são bases. As bases são substâncias que, em solução aquosa, liberam íons hidroxila (OH-) e têm um pH maior que 7. Aqui estão três exemplos de bases comuns que podem ser encontradas em casa:
Hidróxido de sódio (NaOH): também conhecido como soda cáustica, o hidróxido de sódio é frequentemente usado como um produto de limpeza poderoso. Ele pode ser encontrado em produtos para desentupir canos e em alguns produtos de limpeza doméstica.
Bicarbonato de sódio (NaHCO3): o bicarbonato de sódio é um ingrediente versátil que pode ser encontrado na cozinha de muitas casas. Ele é usado para assar, limpar superfícies e neutralizar odores indesejados.
Amônia (NH3): a amônia é frequentemente encontrada em produtos de limpeza para vidros e superfícies. É um agente de limpeza eficaz devido às suas propriedades básicas e capacidade de dissolver gordura e sujeira.
Estes são apenas alguns exemplos de bases que podem ser encontradas em casa. É importante manusear essas substâncias com cuidado e seguir as instruções de segurança ao usá-las.
Onde é possível encontrar as bases necessárias para o projeto?
Para encontrar as bases químicas necessárias para o projeto, é possível procurar em diversos locais dentro de casa. Alguns dos lugares mais comuns onde podemos encontrar bases são:
- Produtos de limpeza: muitos produtos de limpeza doméstica contêm bases químicas, como amônia e soda cáustica.
- Medicamentos: alguns medicamentos, como antiácidos, também podem conter bases em sua composição.
- Produtos de beleza: cremes, shampoos e sabonetes podem conter bases para equilibrar o pH da pele e do cabelo.
- Alimentos: alguns alimentos como bicarbonato de sódio e leite de magnésia são ricos em bases químicas.
É importante lembrar que, ao manipular bases químicas em casa, é essencial tomar precauções de segurança, como usar luvas e óculos de proteção. Além disso, é recomendável ter um conhecimento básico sobre as propriedades e reações das bases para evitar acidentes.
Conheça os diferentes tipos de bases químicas presentes na natureza e na indústria.
As bases químicas são substâncias que têm a capacidade de neutralizar ácidos, formando sais e água. Elas desempenham um papel fundamental em diversos processos químicos, tanto na natureza quanto na indústria. Existem diferentes tipos de bases químicas, cada uma com propriedades específicas e aplicações distintas.
Na natureza, algumas bases químicas comuns incluem o hidróxido de sódio (soda cáustica), o hidróxido de potássio, o hidróxido de amônio e o bicarbonato de sódio. Essas substâncias podem ser encontradas em diversos produtos domésticos, como produtos de limpeza, medicamentos e alimentos.
Na indústria, as bases químicas são amplamente utilizadas em processos de fabricação de diversos produtos, tais como fertilizantes, cosméticos, produtos farmacêuticos, entre outros. Além das bases mencionadas acima, outras bases comuns na indústria incluem o carbonato de cálcio, o hidróxido de cálcio e o hidróxido de alumínio.
Em casa, é possível encontrar bases químicas em diversos produtos do dia a dia, como detergentes, desinfetantes, antiácidos e até mesmo em alguns alimentos. É importante estar ciente dos riscos associados ao manuseio dessas substâncias e seguir corretamente as instruções de uso e armazenamento.
Em resumo, as bases químicas desempenham um papel importante tanto na natureza quanto na indústria, sendo essenciais para diversos processos químicos e aplicações. É fundamental conhecer os diferentes tipos de bases químicas e saber como utilizá-las de forma segura e responsável.
Que bases químicas podem ser encontradas em casa?
As bases químicas estão em muitos produtos para uso diário em casa e em certos alimentos que você nem imagina. Afinal, a ciência está em todo lugar.
Quando comecei a fazer meus estudos de química na universidade, um de meus professores pediu que sejamos curiosos e investigativos, qualidades que caracterizam um bom cientista.

Inspirado por suas palavras, peguei um rolo de papel de tornassol e comecei a medir o pH de tudo o que tinha em minha casa. Fiquei realmente surpreso com a quantidade de coisas que tinham um pH básico em casa.
De fato, lembro que a única coisa que mudou o papel de tornassol para vermelho foi o ketchup (o que é lógico, pois seus ingredientes são tomate e vinagre).
Como mencionei em outros artigos, uma base é um composto químico com a capacidade de aceitar prótons, doar hidroxilos ou possuir um par de elétrons livres. Eles têm a propriedade de neutralizar ácidos, aumentar o pH de uma solução e transformar papel de tornassol azul.
As bases são muito importantes no uso diário e muitas vezes passam despercebidas. Sem bases, as manchas persistentes nas roupas não se soltariam, espelhos sujos seriam produzidos e problemas intestinais como refluxo gástrico e constipação não poderiam ser aliviados (SPM Chemistry Form 4 Notes – Acids and Bases (Part 2), 2013).
Depois, dou uma lista de bases para o uso diário que, na época, davam uma cor azul ao papel de tornassol. Todas essas bases estão nos produtos de uso diário e alimentos (ácidos versus bases, SF).

Exemplos de bases encontradas em casa
1- Café e chá : a molécula de cafeína (1,3,7 trimetilxantina) recebe esse nome após ser descoberta nos grãos de café.
Mais tarde, descobriu-se que também existe em folhas de chá em maior concentração. Esta molécula, uma purina muito semelhante à adenina e por ser uma base de nitrogênio.

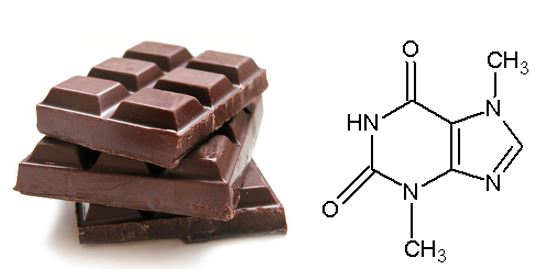
2- Chocolate : semelhante ao café, o chocolate contém um composto chamado teobromina, que é uma base nitrogenada da purina.
Este composto é responsável pelo sabor do chocolate tão bom, no entanto, cães e gatos não metabolizam a teobromina, causando danos ao coração e ao sistema nervoso central . Em conclusão, nunca dê chocolate ao seu animal de estimação (Reactions, 2016).
3- Cloro : O cloro é na verdade hipoclorito ou clorito de sódio, dependendo do cloro da piscina ou da água sanitária.
Os íons hipoclorito e clorito são as bases conjugadas dos ácidos hipocloroso e cloroso, respectivamente, que em solução aquosa têm a capacidade de retirar prótons da água, aumentando a concentração de hidroxilos no meio (ácidos e bases – aplicações na vida real, SF).
ClO – + H 2 O → HClO + OH –
ClO 2 – + H 2 O → HClO 2 + OH –
4- Lixívia : A base comercial mais forte disponível, limpe os fornos e descubra os canos. O soda cáustica , ou hidróxido de sódio (NaOH), é um componente importante dos limpadores de drenos, liquefaz o lixo para que possa ser lavado pelos canos.
Os produtos de limpeza de forno à base de soda cáustica cortam o material cozido no forno. Deve ser manuseado com cuidado, pois pode causar queimaduras químicas graves.

O bicarbonato de sódio é seguro ao toque. Beber algumas pitadas de bicarbonato de sódio dissolvido em água neutralizará parte do excesso de ácido no estômago. Também produz um agente de limpeza levemente abrasivo e não tóxico.
6- Bórax : também conhecido como tetraborato de sódio (Na 2 B4O 7 ● 10H 2 O), uma vez ajudou a preservar múmias no Egito antigo. Agora mantenha a roupa fresca e mate as pragas domésticas. Seu pH de 9,2 significa que é 920 vezes mais alcalino que a água pura.
Bórax dá um ião oxigénio à água para formar peróxido de hidrogénio (H 2 O 2 ) em solução, tornando-se um desinfectante e agente branqueador leve.
Evite manusear o bórax diretamente ou por muito tempo, pois pode causar irritação na pele. O bórax é levemente tóxico se ingerido. (Whitney, 2017).
7- Amoníaco : o termo “amoníaco” refere-se a tanto um gás irritante (NH 3 ) como o produto de limpeza (NH 4 OH) resultante a partir da solução de amoníaco em água. A amônia doméstica tem um pH de 11, ou 50 vezes mais forte que o do leite de magnésia.
É um poderoso limpador doméstico que limpa virtualmente qualquer superfície de sujeira e graxa (Cascio, 2017).

9- Leite de magnésia : este antiácido comum e laxante ganhou seu nome leitoso devido à sua opacidade. O hidróxido de magnésio [Mg (OH) 2 ] tem um pH de 10,5. Preparações comerciais de leite de magnésia usam sabores de menta ou frutas para esconder o sabor amargo que é característico de substâncias alcalinas.
10 – Antiácidos : é comum o uso de bases fracas para aliviar a azia. Os compostos como o bicarbonato de sódio (NaHCO 3 ), carbonato de magnésio (MgCO 3 ), carbonato de cálcio (CaCO 3 ) e hidróxido de alumínio (Al (OH) 3 ) são os ingredientes activos de antiácidos.
11- Desodorizantes : o hidróxido de alumínio também é o ingrediente ativo dos desodorizantes. Atua como bactericida ao eliminar as bactérias que se alimentam das proteínas e gorduras no suor que secretam as glândulas apócrinas (Reaction, 2015).
12- Sabão : o sabão é o produto da neutralização do hidróxido de sódio e do ácido esteárico. Este último é um ácido graxo saturado com 18 átomos de carbono.

O produto dessa neutralização é o estearato de sódio, que forma o íon estearato em uma solução aquosa.
Essa molécula contém uma parte polar e uma não polar para o que é conhecido como molécula anfipática e é responsável pela remoção de gorduras e outros compostos alifáticos da roupa ou do corpo.
Referências
- Ácidos e bases – aplicações da vida real . (SF). Recuperado de scienceclarified.com.
- Ácidos vs. Bases . (SF). Recuperado de acid-vs-bases.weebly.com.
- Cascio, C. (2017, 25 de abril). Exemplos de ácidos e bases do mundo real . Recuperado de sciencing.com.
- (21 de setembro de 2015). Como funcionam os desodorizantes e antitranspirantes? . Recuperado do youtube.com.
- Reacções (18 de janeiro de 2016). Por que o chocolate é ruim para cães? . Recuperado do youtube.com.
- Formulário de Química SPM 4 Notas – Ácidos e Bases (Parte 2) . (2 de março de 2013). Recuperado de berryberryeasy.com.
- Whitney, L. (2017, 25 de abril). Bases usadas como produtos domésticos comuns . Recuperado de sciencing.com.