A reação de neutralização é um tipo de reação química que ocorre entre um ácido e uma base, resultando na formação de um sal e água. Este processo é chamado de neutralização, pois os íons de hidrogênio (H+) do ácido e os íons de hidroxila (OH-) da base se combinam para formar água, neutralizando assim a acidez e a basicidade das substâncias envolvidas.
Os produtos da reação de neutralização são um sal e água, sendo que o sal formado depende dos íons presentes no ácido e na base. Por exemplo, a neutralização do ácido clorídrico (HCl) com hidróxido de sódio (NaOH) resulta na formação de cloreto de sódio (NaCl) e água (H2O).
Alguns exemplos comuns de reações de neutralização incluem a combinação de ácido clorídrico com hidróxido de sódio, ácido sulfúrico com hidróxido de cálcio e ácido acético com hidróxido de potássio. Essas reações são amplamente utilizadas na indústria química e em processos de tratamento de água, ajudando a controlar o pH e a neutralizar substâncias ácidas ou básicas.
Quais as substâncias formadas na reação de neutralização entre ácido e base?
Na reação de neutralização entre ácido e base, são formadas sal e água. Esse tipo de reação química ocorre quando um ácido reage com uma base, resultando na formação de um sal e água como produtos.
O sal formado é resultado da combinação do cátion da base com o ânion do ácido. Já a água é produzida como resultado da reação entre o H+ do ácido e o OH- da base, formando assim a molécula de água.
Um exemplo clássico de reação de neutralização é a reação entre ácido clorídrico (HCl) e hidróxido de sódio (NaOH). Neste caso, o sal formado é o cloreto de sódio (NaCl) e a água é um subproduto da reação.
Portanto, na reação de neutralização entre ácido e base, as substâncias formadas são sal e água, sendo um processo fundamental na química que resulta na neutralização das propriedades ácidas e básicas das substâncias envolvidas.
Entenda o processo de neutralização com um exemplo prático de reação química.
A reação de neutralização é um processo químico que ocorre quando um ácido reage com uma base, resultando na formação de água e um sal. Neste processo, os íons H+ do ácido se combinam com os íons OH- da base, formando moléculas de água. Os íons restantes se combinam para formar um sal. Este processo tem como objetivo neutralizar a acidez ou alcalinidade de uma solução, tornando-a mais neutra.
Um exemplo prático de reação de neutralização é a reação entre o ácido clorídrico (HCl) e o hidróxido de sódio (NaOH). Quando esses dois compostos reagem, ocorre a formação de água (H2O) e cloreto de sódio (NaCl), que é o sal comum de cozinha. A equação química para essa reação é:
HCl + NaOH → NaCl + H2O
Neste exemplo, os íons H+ do ácido clorídrico se combinam com os íons OH- do hidróxido de sódio para formar água, enquanto os íons restantes se combinam para formar cloreto de sódio. Como resultado, a solução ácida do ácido clorídrico e a solução básica do hidróxido de sódio são neutralizadas, produzindo uma solução neutra de sal com água.
Exemplos de reações de neutralização presentes no dia a dia: identifique e compreenda melhor.
As reações de neutralização são processos químicos muito comuns em nosso dia a dia, e é importante compreender suas características, produtos e exemplos. Essas reações ocorrem quando um ácido reage com uma base, formando água e um sal. O sal produzido pode ser neutro, ácido ou básico, dependendo dos reagentes envolvidos.
Um exemplo clássico de reação de neutralização é a mistura de ácido clorídrico (HCl) e hidróxido de sódio (NaOH). Quando esses dois reagentes se encontram, ocorre a formação de água (H2O) e cloreto de sódio (NaCl), que é o sal de cozinha. Neste caso, o pH da solução é neutro, pois o ácido e a base se neutralizaram.
Outro exemplo comum é a neutralização de ácidos presentes em alimentos. Por exemplo, quando adicionamos limão (ácido cítrico) a um prato muito salgado, a acidez do limão neutraliza o excesso de sal, proporcionando um equilíbrio de sabores.
Podemos encontrar reações de neutralização também na agricultura, como na correção do pH do solo. A aplicação de calcário (base) em solos ácidos ajuda a neutralizar a acidez, favorecendo o desenvolvimento das plantas.
Portanto, é importante reconhecer e compreender as reações de neutralização em nosso cotidiano, pois elas desempenham um papel fundamental em diversos processos químicos e contribuem para o equilíbrio e a harmonia em diferentes situações.
Principais características de uma reação de neutralização entre ácido e base.
Uma reação de neutralização entre ácido e base é um processo químico que resulta na formação de água e um sal. Essa reação ocorre quando um ácido reage com uma base, produzindo um composto neutro. Existem algumas características principais que definem esse tipo de reação.
Primeiramente, é importante destacar que a reação de neutralização é uma reação exotérmica, ou seja, libera calor durante o processo. Isso significa que a temperatura do sistema aumenta à medida que a reação ocorre.
Além disso, a reação de neutralização sempre resulta na formação de água e um sal. A água é um dos produtos da reação, enquanto o sal é o composto formado a partir da combinação dos íons do ácido e da base.
Outra característica importante é que a reação de neutralização entre ácido e base envolve a transferência de prótons. O ácido doa um próton para a base, formando água, enquanto os íons restantes se combinam para formar o sal.
Por fim, é importante ressaltar que as reações de neutralização são fundamentais para a química e têm diversas aplicações práticas. Por exemplo, a neutralização de ácidos no estômago por antiácidos é um processo comum que visa equilibrar o pH no organismo.
Em resumo, as reações de neutralização entre ácido e base são processos exotérmicos que resultam na formação de água e um sal, envolvendo a transferência de prótons entre as substâncias. Essas reações são essenciais para a química e têm aplicações importantes no dia a dia.
Reação de neutralização: características, produtos, exemplos
Uma reação de neutralização é aquela que ocorre entre uma espécie ácida e uma reação básica quantitativamente. Em geral, nesse tipo de reação em meio aquoso, a água e um sal (espécies iônicas compostas por um cátion diferente de H + e um ânion diferente de OH – ou O 2- ) são produzidos de acordo com a seguinte equação: ácido + base → sal + água
Em uma reação de neutralização, os eletrólitos têm um impacto, que são aquelas substâncias que, quando dissolvidas na água, geram uma solução que permite a condutividade elétrica. Ácidos, bases e sais são considerados eletrólitos.
Dessa forma, eletrólitos fortes são aquelas espécies que se dissociam completamente em seus íons constituintes quando estão em solução, enquanto eletrólitos fracos apenas ionizam parcialmente (eles têm menos capacidade de conduzir uma corrente elétrica; ou seja, eles não são bons condutores como eletrólitos fortes).
Caracteristicas
Primeiro, deve-se enfatizar que, se uma reação de neutralização começar com quantidades iguais de ácido e base (em moles), quando a referida reação terminar, apenas um sal será obtido; isto é, não há quantidades residuais de ácido ou base.
Além disso, uma propriedade muito importante das reações ácido-base é o pH, que indica quão ácida ou básica é uma solução. Isso é determinado pela quantidade de íons H + encontrados nas soluções medidas.
Por outro lado, existem vários conceitos de acidez e basicidade, dependendo dos parâmetros que são levados em consideração. Um conceito que se destaca é o de Brønsted e Lowry, que considera o ácido como uma espécie capaz de doar prótons (H + ) e a base como a espécie capaz de aceitá-los.
Titulações ácido-base
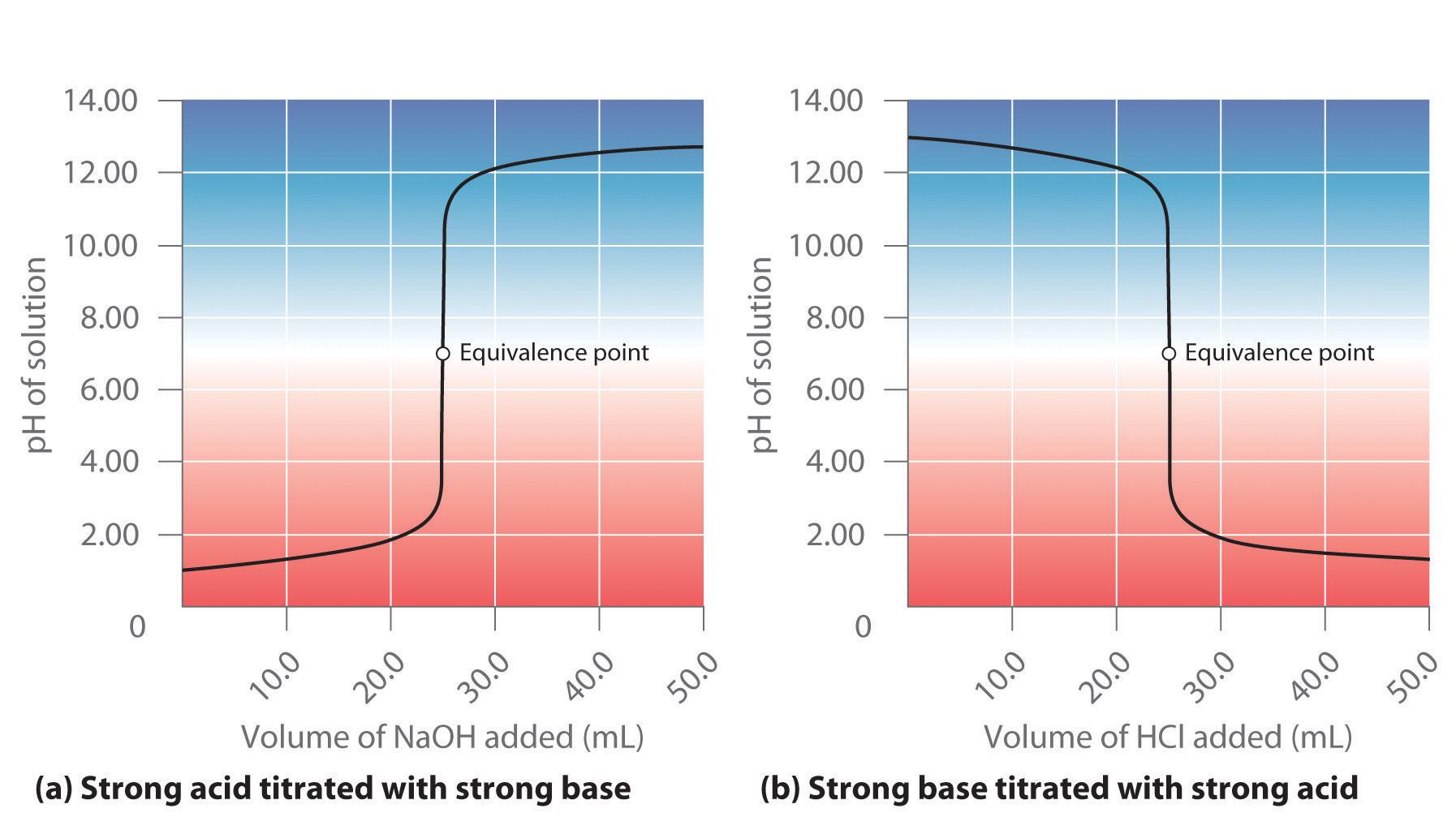
Para estudar adequadamente e quantitativamente uma reação de neutralização entre um ácido e uma base, é aplicada uma técnica chamada titulação ácido-base (ou titulação).
As titulações ácido-base consistem em determinar a concentração de ácido ou base necessária para neutralizar uma certa quantidade de base ou ácido de concentração conhecida.
Na prática, uma solução padrão (cuja concentração é conhecida exatamente) deve ser gradualmente adicionada à solução cuja concentração é desconhecida até que o ponto de equivalência seja atingido, onde uma das espécies neutralizou completamente a outra.
O ponto de equivalência é detectado pela violenta mudança de cor do indicador que foi adicionado à solução de concentração desconhecida quando a reação química entre as duas soluções foi concluída.
Por exemplo, no caso da neutralização de ácido fosfórico (H 3 PO 4 ), haverá um ponto de equivalência para cada protão que aparece a partir do ácido; isto é, três pontos de equivalência serão obtidos e três alterações de cor serão observadas.
Produtos de uma reação de neutralização
Nas reações de um ácido forte com uma base forte, é realizada a completa neutralização da espécie, como na reação entre o ácido clorídrico e o hidróxido de bário:
2HCl (aq) + Ba (OH) 2 (aq) → BaCl 2 (aq) + 2H 2 O (l)
Portanto, nenhum íon H + ou OH é gerado – em excesso, o que significa que o pH de soluções eletrolíticas fortes que foram neutralizadas está intrinsecamente relacionado à natureza ácida de seus reagentes.
Pelo contrário, no caso de neutralização entre um eletrólito fraco e um forte (ácido forte + base fraca ou ácido fraco + base forte) é obtida a dissociação parcial do eletrólito fraco e a constante de dissociação ácida aparece (K a ) ou da base fraca (K b ), para determinar a natureza ácida ou básica da reação líquida, calculando o pH.
Por exemplo, você tem a reação entre o ácido cianídrico e o hidróxido de sódio:
HCN (aq) + NaOH (aq) → NaCN (aq) + H 2 O (l)
Nesta reação, o eletrólito fraco não ioniza visivelmente na solução, portanto a equação iônica líquida é representada da seguinte forma:
HCN (aq) + OH – (aq) → CN – (aq) + H 2 O (l)
Isto é obtido após a reação da reação com os eletrólitos fortes em sua forma dissociada (Na + (ac) + OH – (ac) no lado dos reagentes, e Na + (ac) + CN – (ac) no lado de produtos), onde apenas o íon sódio é um espectador.
Finalmente, no caso da reação entre um ácido fraco e uma base fraca, essa neutralização não ocorre. Isso ocorre porque ambos os eletrólitos se dissociam parcialmente, sem resultar na água e no sal esperados.
Exemplos
Ácido forte + base forte
A reação dada entre ácido sulfúrico e hidróxido de potássio em meio aquoso é usada como exemplo, de acordo com a seguinte equação:
H 2 SO 4 (ac) + 2 KOH (ac) → K 2 SO 4 (ac) + 2H 2 O (l)
Pode-se ver que tanto o ácido quanto o hidróxido são eletrólitos fortes; portanto, eles ionizam completamente na solução. O pH desta solução dependerá do eletrólito forte que está em maior proporção.
Ácido forte + base fraca
A neutralização do ácido nítrico com amônia resulta no composto de nitrato de amônio, como mostrado abaixo:
HNO 3 (ac) + NH 3 (ac) → NH 4 NO 3 (ac)
Nesse caso, a água produzida ao lado do sal não é observada, pois deve ser representada como:
HNO 3 (aq) + NH 4 + (aq) + OH – (aq) → NH 4 NO 3 (aq) + H 2 O (l)
Então a água pode ser vista como um produto da reação. Nesse caso, a solução terá um pH essencialmente ácido.
Ácido fraco + base forte
A reação que ocorre entre o ácido acético e o hidróxido de sódio é mostrada abaixo:
CH 3 COOH (aq) + NaOH (aq) → CH 3 COONa (aq) + H 2 O (l)
Como o ácido acético é um eletrólito fraco, ele se dissocia parcialmente, resultando em acetato de sódio e água, cuja solução terá um pH básico.
Ácido fraco + base fraca
Finalmente, e como afirmado anteriormente, uma base fraca não pode neutralizar um ácido fraco; Isso não acontece pelo contrário. Ambas as espécies são hidrolisadas em solução aquosa e o pH da solução dependerá da “força” do ácido e da base.
Referências
- Wikipedia (sf). Neutralização (Química). Recuperado de en.wikipedia.org
- Chang, R. (2007). Chemistry, nona edição (McGraw-Hill).
- Raymond, KW (2009). Química Orgânica e Biológica Geral. Recuperado de books.google.co.ve
- Joesten, MD, Hogg, JL e Castellion, ME (2006). O mundo da química: fundamentos. Recuperado de books.google.co.ve
- Clugston, M. e Flemming, R. (2000). Química Avançada Recuperado de books.google.co.ve
- Reger, DL, Goode, SR e Ball, DW (2009). Química: Princípios e Prática. Recuperado de books.google.co.ve