A Teoria do Mar de Elétrons é um modelo utilizado na química sólida para descrever as propriedades dos metais. Segundo essa teoria, os elétrons presentes na camada de valência dos átomos metálicos se comportam como se estivessem livres para se moverem através da estrutura cristalina do metal, formando o chamado “mar de elétrons”. Neste texto, vamos explorar os fundamentos e as propriedades relacionadas à Teoria do Mar de Elétrons, discutindo como ela explica fenômenos como a condutividade elétrica e térmica dos metais, sua maleabilidade e ductilidade, entre outras características únicas desses materiais.
Teoria do mar de elétrons: compreendendo a distribuição dos elétrons na estrutura dos metais.
A Teoria do Mar de Elétrons é um modelo utilizado para explicar a distribuição dos elétrons na estrutura dos metais. De acordo com essa teoria, os elétrons em um metal estão livres para se moverem através de uma “nuvem” de elétrons deslocalizados, formando o chamado “mar de elétrons”.
Esses elétrons deslocalizados são responsáveis por diversas propriedades dos metais, como a condutividade elétrica e térmica, a maleabilidade e a ductilidade. Isso ocorre porque os elétrons livres são capazes de se moverem facilmente sob a influência de um campo elétrico ou térmico, permitindo a passagem de corrente elétrica ou calor.
Além disso, a Teoria do Mar de Elétrons também ajuda a explicar a ligação metálica, que é a ligação que ocorre entre os átomos de um metal. Nesse tipo de ligação, os elétrons de valência dos átomos metálicos são compartilhados por todos os átomos da estrutura, criando uma rede de elétrons deslocalizados.
Em resumo, a Teoria do Mar de Elétrons é fundamental para compreendermos as propriedades únicas dos metais e como a distribuição dos elétrons na estrutura dos metais influencia seu comportamento físico e químico.
Conheça as características das ligações metálicas e suas propriedades únicas no contexto da Química.
A Teoria do Mar de Elétrons é fundamental para compreender as características das ligações metálicas e suas propriedades únicas na Química. De acordo com essa teoria, os metais possuem uma estrutura cristalina na qual os elétrons de valência não estão ligados a átomos específicos, mas sim livres para mover-se através do retículo cristalino.
Esses elétrons livres formam o que chamamos de nuvem de elétrons, que é responsável por algumas propriedades peculiares dos metais. Uma delas é a condutividade elétrica, já que os elétrons livres podem mover-se facilmente quando uma diferença de potencial elétrico é aplicada. Além disso, a maleabilidade e ductilidade dos metais também são consequências da mobilidade dos elétrons na estrutura metálica.
Outra propriedade importante das ligações metálicas é a alta condutividade térmica, que está relacionada à capacidade dos elétrons livres de transferir energia térmica através do material de forma eficiente. Além disso, a resistência à corrosão dos metais também é atribuída à sua estrutura cristalina e às ligações metálicas.
Em resumo, as ligações metálicas são essenciais para as propriedades únicas dos metais, como condutividade elétrica e térmica, maleabilidade, ductilidade e resistência à corrosão. A Teoria do Mar de Elétrons nos ajuda a compreender como essas propriedades surgem a partir da estrutura atômica dos metais e da mobilidade dos elétrons na sua estrutura cristalina.
Entendendo o mar de elétrons presente nas ligações metálicas.
A Teoria do Mar de Elétrons é fundamental para compreender as propriedades das ligações metálicas. Nesse modelo, os átomos de um metal são vistos como íons positivos imersos em um “mar” de elétrons livres. Esses elétrons estão deslocalizados e não pertencem a nenhum átomo específico, podendo mover-se livremente através da estrutura metálica.
Essa mobilidade dos elétrons livres é o que confere às substâncias metálicas suas propriedades únicas, como condutividade elétrica e térmica, maleabilidade e ductilidade. Os elétrons livres são capazes de transportar carga elétrica e calor de forma eficiente, o que explica por que os metais são bons condutores de eletricidade e calor.
Além disso, a liberdade de movimento dos elétrons também contribui para a maleabilidade e ductilidade dos metais. Os elétrons podem deslocar-se facilmente sob a aplicação de pressão ou tensão, permitindo que os átomos metálicos se desloquem uns sobre os outros sem quebrar a estrutura.
Em resumo, a Teoria do Mar de Elétrons nos ajuda a entender como os metais funcionam e por que exibem as propriedades características que conhecemos. É importante considerar a presença desse “mar” de elétrons livres ao estudar as ligações metálicas e suas aplicações em diversos campos da ciência e da tecnologia.
Características das substâncias metálicas: o que você precisa saber sobre seus propriedades.
A Teoria do Mar de Elétrons é um modelo que explica as propriedades das substâncias metálicas com base na ideia de que os elétrons em um metal estão livres para se moverem em um mar de elétrons. Este modelo ajuda a entender diversas características das substâncias metálicas, tais como condutividade elétrica e térmica, maleabilidade, ductilidade e brilho característico.
Uma das principais características das substâncias metálicas é a sua alta condutividade elétrica. Isso ocorre devido à presença dos elétrons livres, que podem se mover facilmente através da estrutura metálica, permitindo a passagem da corrente elétrica. Além disso, os metais também possuem alta condutividade térmica, o que significa que podem transferir calor de forma eficiente.
Outra propriedade importante dos metais é a sua maleabilidade e ductilidade. A maleabilidade se refere à capacidade de um metal ser moldado em diferentes formas sem se quebrar, enquanto a ductilidade se relaciona com a capacidade de ser transformado em fios finos. Essas características são resultado da estrutura cristalina dos metais, que permite que os átomos deslizem facilmente uns sobre os outros.
Além disso, os metais também possuem um brilho característico, conhecido como brilho metálico. Isso ocorre devido à capacidade dos elétrons livres de absorverem e refletirem a luz de forma eficiente. Esse brilho é uma das razões pelas quais os metais são amplamente utilizados em joias e objetos decorativos.
Em resumo, a Teoria do Mar de Elétrons é fundamental para entender as propriedades das substâncias metálicas. A presença dos elétrons livres no metal permite explicar suas características únicas, como condutividade elétrica e térmica, maleabilidade, ductilidade e brilho metálico.
Teoria do Mar de Elétrons: Fundamentos e Propriedades
A teoria do mar de elétrons é uma hipótese que explica um fenômeno químico excepcional que ocorre nas ligações metálicas entre elementos com baixa eletronegatividade. É o compartilhamento de elétrons entre átomos diferentes, unidos por ligações metálicas.
A densidade eletrônica entre essas ligações é tal que os elétrons são deslocalizados e formam um “mar” onde se movem livremente. Também pode ser expresso pela mecânica quântica: alguns elétrons (geralmente um a sete por átomo) estão dispostos em orbitais com múltiplos centros que se estendem pela superfície do metal.
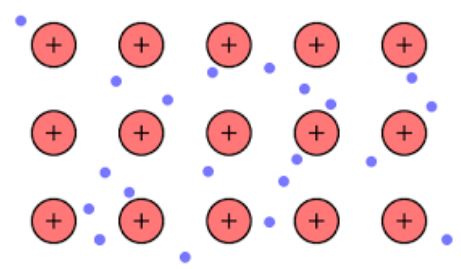
Além disso, os elétrons retêm uma certa localização no metal, embora a distribuição de probabilidade da nuvem eletrônica tenha uma densidade mais alta em torno de alguns átomos específicos. Isso ocorre porque quando uma certa corrente é aplicada, elas manifestam sua condutividade em uma direção específica.
Fundamentos da teoria do mar de elétrons
Os elementos metálicos têm grande tendência a doar elétrons de seu último nível de energia (camada de valência), devido à sua energia de ionização tão baixa em relação aos outros elementos.
Sabendo disso, cada elemento metálico poderia ser considerado como um cátion ligado ao elétron de seu último nível de energia, o que seria mais propenso a doações.
Como um metal tem um grande número de átomos que estão ligados entre si, pode-se presumir que o referido metal forma um grupo de cátions metálicos que estão submersos em uma espécie de mar de elétrons de valência que possuem uma grande deslocalização.
Considerando que as forças de atração eletrostática entre o cátion (carga positiva) e o elétron (carga negativa) têm átomos metálicos fortemente ligados, imagine a deslocalização dos elétrons de valência se comportando como um adesivo eletrostático que mantém ligações para os cátions metálicos.
Dessa maneira, pode-se inferir que quanto maior o número de elétrons presentes na camada de valência de um metal, esse tipo de adesivo eletrostático terá maior resistência.
Propriedades
A teoria do mar de elétrons oferece uma explicação simples para as características de espécies metálicas como resistência, condutividade, ductilidade e maleabilidade, que variam de um metal para outro.
Foi descoberto que a resistência conferida aos metais se deve à grande deslocalização de seus elétrons, o que gera uma força de coesão muito alta entre os átomos que o formam.
Dessa maneira, a ductilidade é conhecida como a capacidade de certos materiais de permitir a deformação de sua estrutura, sem ceder o suficiente para quebrar, quando sujeitos a certas forças.
Realocação em camadas
Tanto a ductilidade quanto a maleabilidade de um metal são determinadas pelo fato de que os elétrons de valência se deslocalizam em todas as direções na forma de camadas, o que faz com que eles se movam um sobre o outro em face de uma força externa, evitando quebra da estrutura metálica, mas permitindo sua deformação.
Da mesma forma, a liberdade de movimento de elétrons deslocalizados permite que uma corrente elétrica flua, fazendo com que os metais tenham uma condutividade elétrica muito boa.
Além disso, esse fenômeno de livre circulação de elétrons permite a transferência de energia cinética entre as diferentes regiões do metal, o que promove a transmissão de calor e faz com que os metais manifestem uma grande condutividade térmica.
Teoria do mar de elétrons em cristais metálicos
Os cristais são substâncias sólidas que possuem propriedades físicas e químicas – como densidade, ponto de fusão e dureza – que são estabelecidas pelo tipo de força que faz com que as partículas que os formam fiquem juntas.
De certa forma, considera-se que os cristais do tipo metal possuem estruturas mais simples, porque cada “ponto” da rede de cristais foi ocupado por um átomo do próprio metal.
Nesse mesmo sentido, foi determinado que geralmente a estrutura dos cristais metálicos é cúbica e se concentra nas faces ou no corpo.
No entanto, essas espécies também podem ter uma forma hexagonal e uma embalagem bastante compacta, o que lhes confere a enorme densidade que é característica delas.
Devido a esse motivo estrutural, as ligações formadas nos cristais metálicos são diferentes daquelas que ocorrem nas outras classes de cristais. Os elétrons que podem formar ligações são deslocalizados por toda a estrutura cristalina, como explicado acima.

Desvantagens da teoria
Nos átomos de metal, há uma pequena quantidade de elétrons de valência na proporção de seus níveis de energia; isto é, existe uma quantidade maior de estados de energia disponível do que a quantidade de elétrons ligados.
Isso implica que, uma vez que há uma forte realocação eletrônica e também faixas de energia que foram parcialmente preenchidas, os elétrons podem se mover através da estrutura reticular quando são submetidos a um campo elétrico vindo de fora, além de formar o oceano de elétrons que suporta a permeabilidade da rede.
Portanto, a união de metais é interpretada como um conglomerado de íons com carga positiva acoplados por um mar de elétrons (carga negativa).
No entanto, existem características que não são explicadas por este modelo, como a formação de certas ligas entre metais com composições específicas ou a estabilidade de ligações metálicas coletivas, entre outras.
Essas desvantagens são explicadas pela mecânica quântica, porque essa teoria e muitas outras abordagens foram estabelecidas com base no modelo mais simples de um único elétron, enquanto tentavam aplicar em estruturas muito mais complexas de átomos multieletrônicos.
Referências
- Wikipedia (2018). Wikipedia Recuperado de en.wikipedia.org
- Holman, JS e Stone, P. (2001). Química Recuperado de books.google.co.ve
- Parkin, G. (2010). Ligação Metal-Metal. Recuperado de books.google.co.ve
- Rohrer, GS (2001). Estrutura e Ligação em Materiais Cristalinos. Recuperado de books.google.co.ve
- Ibach, H. e Lüth, H. (2009). Física do estado sólido: uma introdução aos princípios da ciência dos materiais. Recuperado de books.google.co.ve