A trietilamina é um composto químico orgânico que possui a fórmula molecular (C2H5)3N. Sua estrutura consiste em três grupos etila ligados a um átomo de nitrogênio, formando uma molécula triédrica. É um líquido incolor com odor característico de amônia, altamente volátil e inflamável.
Suas propriedades incluem ser solúvel em água, álcoois e éteres, e reagir violentamente com ácidos fortes. A trietilamina é amplamente utilizada na indústria química como catalisador, agente tamponante e intermediário na síntese de compostos orgânicos.
No entanto, deve-se ter cuidado ao manusear a trietilamina devido aos seus riscos à saúde, como irritação na pele, olhos e vias respiratórias. Além disso, é importante tomar precauções devido à sua inflamabilidade e reatividade com outros produtos químicos. Em resumo, a trietilamina é um composto versátil, mas que requer cuidados especiais no seu uso e manipulação.
Propriedades químicas da trietanolamina: o que você precisa saber sobre essa substância.
A trietanolamina é um composto químico com fórmula C6H15NO3, que consiste em um álcool tri-hidroxilado e uma amina terciária. Possui propriedades químicas que a tornam útil em várias aplicações industriais e comerciais.
Uma das principais propriedades da trietanolamina é a sua capacidade de atuar como agente tamponante, regulando o pH de soluções aquosas. Além disso, ela pode ser utilizada como emulsificante em cosméticos e produtos de cuidados pessoais, devido à sua capacidade de misturar substâncias insolúveis em água.
Outra propriedade importante da trietanolamina é a sua capacidade de reagir com ácidos para formar sais. Isso a torna um componente essencial em formulações de produtos de limpeza, devido à sua capacidade de neutralizar ácidos e agir como agente surfactante.
No entanto, é importante ressaltar que a trietanolamina pode apresentar riscos à saúde e ao meio ambiente. O seu uso excessivo ou inadequado pode causar irritação na pele e nos olhos, além de contribuir para a poluição da água e do solo.
Em resumo, a trietanolamina é uma substância química com diversas propriedades úteis, sendo amplamente utilizada em diferentes setores industriais. No entanto, é essencial tomar precauções ao manuseá-la e garantir que seja utilizada de forma segura e responsável.
Finalidade da trietilamina na indústria química e farmacêutica: descubra sua importância e aplicações.
A trietilamina é um composto químico de fórmula (C2H5)3N, também conhecido como N,N-Dietiletanamina. Possui uma estrutura molecular simples, consistindo em três grupos etila ligados a um átomo de nitrogênio. É um líquido incolor com um forte odor característico de amônia.
Na indústria química, a trietilamina é amplamente utilizada como catalisador em diversas reações de alquilação e acetilação. Sua presença acelera esses processos, aumentando a eficiência da produção de compostos orgânicos. Além disso, é empregada na síntese de produtos farmacêuticos, corantes, resinas e agentes de cura de polímeros.
Na indústria farmacêutica, a trietilamina desempenha um papel crucial na fabricação de medicamentos. É utilizada na síntese de diversos princípios ativos, auxiliando na formação de ligações químicas essenciais para a eficácia dos fármacos. Além disso, sua capacidade de neutralizar ácidos a torna um componente importante em formulações farmacêuticas.
Apesar de sua importância na indústria química e farmacêutica, é importante ressaltar que a trietilamina apresenta alguns riscos. Seu manuseio inadequado pode causar irritação na pele, olhos e vias respiratórias. Portanto, é fundamental adotar medidas de segurança ao trabalhar com esse composto, como a utilização de EPIs e a manipulação em ambientes bem ventilados.
Em resumo, a trietilamina desempenha um papel fundamental na indústria química e farmacêutica, sendo essencial para a síntese de diversos compostos orgânicos e medicamentos. Sua capacidade catalítica e propriedades químicas a tornam um componente valioso em processos de produção e pesquisa. No entanto, é necessário ter cuidado ao lidar com esse composto, a fim de evitar possíveis riscos à saúde.
Descubra o pH da trietanolamina em um simples teste de laboratório.
A trietilamina é um composto químico comumente utilizado em laboratórios e na indústria devido às suas propriedades básicas e capacidade de neutralizar ácidos. Para descobrir o pH da trietanolamina em um simples teste de laboratório, basta seguir alguns passos simples.
Primeiro, adicione uma pequena quantidade de trietilamina a uma solução aquosa. Em seguida, utilize papel indicador de pH para testar a acidez ou basicidade da solução. O papel indicador mudará de cor, indicando o pH da solução.
É importante ressaltar que a trietanolamina é uma base fraca, portanto, a solução provavelmente terá um pH alcalino. Para obter um resultado mais preciso, é recomendável utilizar um medidor de pH digital.
A trietanolamina é comumente utilizada na fabricação de produtos cosméticos, como cremes e loções, devido às suas propriedades emolientes e neutralizantes. No entanto, é importante manusear esse composto com cuidado, pois pode causar irritações na pele e nos olhos.
Em resumo, descobrir o pH da trietanolamina em um simples teste de laboratório é fácil e pode ser feito com papel indicador de pH ou um medidor digital. É importante lembrar que a trietanolamina é uma base fraca e deve ser manipulada com cuidado devido aos seus potenciais riscos à saúde.
Trietilamina: estrutura, propriedades, usos e riscos
A trietilamina é um composto orgânico, mais especificamente, uma amina alifática, cuja fórmula química é N (CH 2 CH 3 ) 3 ou NEt 3 . Como outras aminas líquidas, possui um odor semelhante ao da amônia misturada com o peixe; seus vapores tornam tedioso e perigoso manusear essa substância sem um exaustor ou roupas apropriadas.
Além de suas respectivas fórmulas, esse composto é frequentemente abreviado como ASD; no entanto, isso pode causar confusão com outras aminas, como trietanolamina, N (EtOH) 3 ou tetraetilamônio, uma amina quaternária, NEt 4 + .

Pelo esqueleto (imagem superior), pode-se dizer que a trietilamina se parece bastante com amônia; enquanto a segunda tem três hidrogénios, NH 3 , a primeira tem três grupos etilo, N (CH 2 CH 3 ) 3 . Sua síntese parte do tratamento da amônia líquida com etanol, ocorrendo uma alquilação.
NEt 3 pode formar um sal higroscópico com HCl: cloridrato de trietilamina, NEt 3 · HCl. Além disso, participa como catalisador homogêneo na síntese de ésteres e amidas, tornando-o um solvente necessário em laboratórios orgânicos.
Além disso, juntamente com outros reagentes, permite a oxidação de álcoois primários e secundários em aldeídos e cetonas, respectivamente. Como a amônia, é uma base e, portanto, pode formar sais orgânicos por reações de neutralização.
Estrutura de trietilamina

Na imagem acima, a estrutura da trietilamina é mostrada com um modelo de esferas e barras. No centro da molécula está o átomo de nitrogênio, representado por uma esfera azulada; e ligados a ele, os três grupos etil, como pequenos galhos de esferas preto e branco.
Embora não seja visível a olho nu, há um par de elétrons não compartilhados no átomo de nitrogênio. Esses dois elétrons e os três grupos -CH 2 CH 3 sofrem repulsões eletrônicas; mas, por outro lado, contribuem para definir o momento dipolar da molécula.
No entanto, esse momento dipolar é menor que, por exemplo, dietilamina, NHEt 2 ; e da mesma forma, não há possibilidade de formar pontes de hidrogênio.
Isso ocorre porque não há ligação NH na trietilamina e, consequentemente, menores pontos de fusão e ebulição são observados em comparação com outras aminas que interagem dessa maneira.
Embora exista um leve momento dipolar, as forças de dispersão entre os grupos etil das moléculas NEt 3 vizinhas não podem ser descartadas . Adicionando esse efeito, justifica-se por que, embora a trietilamina seja volátil, ela ferve a cerca de 89 ° C, graças à sua massa molecular relativamente grande.
Propriedades
Aparência física
Líquido incolor com um cheiro desagradável de amônia e peixe.
Massa molar
101,193 g / mol.
Ponto de ebulição
89 ° C.
Ponto de fusão
-115 ° C. Observe quão fracas são as forças intermoleculares que ligam as moléculas de trietilamina em seus sólidos.
Densidade
0,7255 g / mL.
Solubilidade
É relativamente solúvel em água, 5,5 g / 100g a 20 ° C. Abaixo de 18,7 ° C, segundo Pubchem, é até miscível com ele.
Além de “se dar bem” com a água, também é solúvel em acetona, benzeno, etanol, éter e parafina.
Densidade de vapor
3,49 em relação ao ar.
Pressão de vapor
57,07 mmHg a 25 ° C.
Constante de Henry
66 μmol / Pa · Kg.
Ponto de inflamação
-15 ° C.
Temperatura de auto-ignição
312 ° C.
Capacidade de calor
216,43 kJ / mol.
Calor de combustão
10.248 cal / g.
Calor de vaporização
34,84 kJ / mol.
Tensão superficial
20,22 N / m a 25 ° C.
Índice de refração
1.400 a 20 ° C.
Viscosidade
0,347 mPa · sa 25 ° C.
Constante de basicidade
A trietilamina tem um pKb igual a 3,25.
Basicity
A basicidade para esta amina pode ser expressa pela seguinte equação química:
NEt 3 + HA <=> NHEt 3 + + A –
Onde o HA é uma espécie ácida fraca. O par NHEt 3 + A – forma o que se torna um sal terciário de amônio.
O ácido conjugado NHEt 3 + é mais estável que o amônio, NH 4 + , porque os três grupos etil doam parte de sua densidade eletrônica para reduzir a carga positiva no átomo de nitrogênio; portanto, a trietilamina é mais básica que a amônia (mas menos básica que a OH – ).
Usos
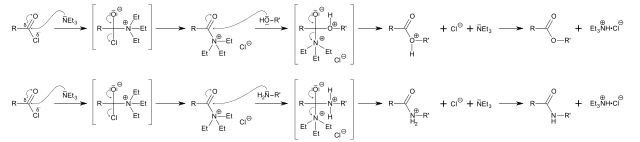
A basicidade, neste caso, a nucleofilicidade da trietilamina é usada para catalisar a síntese de ésteres e amidas a partir de um substrato em comum: um cloreto de acila, RCOCl (imagem superior).
Aqui o par de elétrons livres de nitrogênio ataca o grupo carbonil, formando um intermediário; que, consecutivamente, é atacado por um álcool ou uma amina para formar um éster ou amida, respectivamente.
Na primeira linha da imagem, o mecanismo que segue a reação para produzir o éster é visualizado, enquanto a segunda linha corresponde à amida. Observe que ambas as reações produzem cloridrato de trietilamina, NEt 3 · HCl, a partir do qual o catalisador é recuperado para iniciar outro ciclo.
Polímeros
A nucleofilicidade da trietilamina também é usada para ser adicionada a certos polímeros, curando-os e dando-lhes massas maiores. Por exemplo, faz parte da síntese de resinas policarbonadas, espumas de poliuretano e resinas epóxi.
Cromatografia
Sua anfifilicidade e volatilidade remotas permitem que seus sais derivados sejam utilizados como reagentes na cromatografia de troca iônica. Outra utilização implícita de trietilamina é que ele pode ser obtido mais sais de aminas terciárias, tais como bicarbonato de trietilamina, NHEt 3 HCO 3 (ou TEAB).
Produtos comerciais
Tem sido utilizado como aditivo na formulação de cigarros e tabaco, conservantes alimentares, produtos de limpeza de pisos, aromas, pesticidas, corantes, etc.
Riscos
Os vapores de trietilamina não são apenas desagradáveis, mas perigosos, pois podem irritar o nariz, a garganta e os pulmões, causando edema pulmonar ou bronquite. Além disso, sendo mais densos e pesados que o ar, eles permanecem no nível do solo, movendo-se para possíveis fontes de calor para explodir posteriormente.
Os recipientes deste líquido devem estar tão longe do fogo quanto representam um perigo iminente de explosão.
Além disso, deve-se evitar o contato com espécies ou reagentes, tais como: metais alcalinos, ácido tricloroacético, nitratos, ácido nítrico (como formar nitrosoaminas, compostos cancerígenos), ácidos fortes, peróxidos e permanganatos.
Você não deve tocar em alumínio, cobre, zinco ou suas ligas, pois ele pode corroer.
Em relação ao contato físico, pode causar alergia e erupções cutâneas se a exposição for aguda. Além dos pulmões, pode afetar o fígado e os rins. E em relação ao contato visual, causa irritação, que pode até danificar os olhos se não forem tratados ou limpos a tempo.
Referências
- Morrison, RT e Boyd, R., N. (1987). Quimica Organica. 5ª Edição. Editorial Addison-Wesley Interamerican.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill
- Graham Solomons TW, Craig B. Fryhle. (2011). Química Orgânica Aminas (10ª edição). Wiley Plus
- Wikipedia (2019). Trietilamina Recuperado de: en.wikipedia.org
- Merck. (2019). Trietilamina Recuperado de: sigmaaldrich.com
- Centro Nacional de Informação Biotecnológica. (2019). Trietilamina Banco de Dados PubChem. CID = 8471. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Rede de dados de toxicologia. (sf). Trietilamina Recuperado de: toxnet.nlm.nih.gov
- Departamento de Saúde de Nova Jersey. (2010). Trietilamina Recuperado de: nj.gov