O ácido clorídrico (HI) é uma substância química inorgânica composta por hidrogênio e cloro. É uma solução aquosa altamente corrosiva e ácida, com um pH extremamente baixo. Sua estrutura molecular é formada por um átomo de hidrogênio ligado a um átomo de cloro.
O ácido clorídrico tem diversas propriedades, sendo altamente solúvel em água e capaz de reagir com uma ampla gama de substâncias químicas. É um ácido forte que pode corroer metais, tecidos e materiais diversos. Além disso, é altamente tóxico e deve ser manuseado com cuidado.
Os usos do ácido clorídrico são variados, sendo amplamente empregado na indústria química, na limpeza de superfícies e na produção de diversos produtos químicos. Também é utilizado na indústria de alimentos, na purificação de minerais, na limpeza de piscinas e em processos de tratamento de água. No entanto, devido à sua natureza corrosiva e tóxica, é importante seguir as medidas de segurança ao lidar com o ácido clorídrico.
Propriedades do ácido clorídrico: o que você precisa saber sobre essa substância corrosiva.
O ácido clorídrico, também conhecido pela fórmula HCl, é uma substância extremamente corrosiva e perigosa se manuseada de forma inadequada. É uma solução aquosa de gás cloro e água, e é amplamente utilizado em processos industriais, laboratoriais e até mesmo em limpeza doméstica.
Uma das principais propriedades do ácido clorídrico é a sua capacidade altamente corrosiva, o que o torna um agente de limpeza eficaz para remover depósitos minerais e outros resíduos. Além disso, o HCl é altamente solúvel em água e possui um odor pungente e irritante.
Outra propriedade importante do ácido clorídrico é a sua capacidade de reagir com metais, formando cloretos metálicos e liberando gás hidrogênio. Essa reação pode ser violenta em alguns casos, especialmente com metais como o alumínio e o zinco.
Por ser uma substância altamente corrosiva, é essencial tomar precauções ao manusear o ácido clorídrico. É importante usar equipamentos de proteção adequados, como luvas, óculos de proteção e avental. Além disso, o HCl deve ser armazenado em recipientes apropriados, longe de substâncias incompatíveis que possam causar reações perigosas.
Em resumo, o ácido clorídrico é uma substância química extremamente corrosiva e perigosa, mas também possui diversas aplicações industriais e laboratoriais. Ao conhecer suas propriedades e saber como manuseá-lo de forma segura, é possível aproveitar os benefícios desse composto químico sem correr riscos desnecessários.
Para que serve o ácido clorídrico em processos químicos e industriais?
O ácido clorídrico, também conhecido como ácido muriático, é uma substância química altamente corrosiva e ácida. Sua fórmula química é HCl e é composto por um átomo de hidrogênio e um átomo de cloro. Em sua forma pura, o ácido clorídrico é um líquido incolor e altamente ácido, com um odor pungente e irritante.
Devido às suas propriedades corrosivas e ácidas, o ácido clorídrico é amplamente utilizado em processos químicos e industriais. Uma de suas principais aplicações é na indústria de limpeza, onde é usado para remover depósitos minerais e incrustações de equipamentos industriais. Além disso, o ácido clorídrico é utilizado na produção de produtos químicos, como cloreto de vinila e ácido clorídrico.
Outra aplicação importante do ácido clorídrico é na indústria de alimentos, onde é utilizado como regulador de acidez e agente conservante. Ele também é utilizado na produção de medicamentos, na indústria metalúrgica e na fabricação de produtos de limpeza doméstica.
Em resumo, o ácido clorídrico desempenha um papel fundamental em vários processos químicos e industriais devido às suas propriedades corrosivas e ácidas. Sua versatilidade e eficácia o tornam uma substância química essencial em diversas aplicações industriais e comerciais.
Características e propriedades do ácido: o que você precisa saber sobre essa substância.
O ácido clorídrico, também conhecido pela fórmula HI, é uma substância altamente corrosiva e ácida. Ele é uma solução aquosa do gás cloro em água e é amplamente utilizado na indústria química e em laboratórios. O ácido clorídrico é incolor e possui um odor pungente característico.
Uma das principais características do ácido clorídrico é a sua capacidade de reagir com metais para formar seus respectivos cloretos e liberar hidrogênio gasoso. Além disso, ele é um ácido forte, o que significa que ele se dissocia completamente em íons hidrogênio (H+) e íons cloreto (Cl-) em solução aquosa.
As propriedades do ácido clorídrico incluem sua capacidade de corroer materiais como metais, vidro e cerâmica. Além disso, ele é altamente solúvel em água e é um bom condutor de eletricidade quando ionizado. O ácido clorídrico também é altamente inflamável e deve ser manuseado com cuidado.
Em relação aos usos do ácido clorídrico, ele é amplamente utilizado na limpeza de superfícies metálicas, na produção de produtos químicos como cloreto de polivinila (PVC) e na indústria de alimentos para regular o pH de certos produtos. Além disso, o ácido clorídrico é utilizado em laboratórios para ajustar o pH de soluções e como reagente em diversas sínteses químicas.
Em suma, o ácido clorídrico é uma substância química corrosiva e ácida com diversas aplicações na indústria e em laboratórios. É importante manuseá-lo com cuidado devido à sua natureza corrosiva e inflamável.
Aprenda a utilizar o ácido clorídrico de forma segura e eficaz em processos específicos.
O ácido clorídrico (HCl) é uma substância química altamente corrosiva e ácida, amplamente utilizada em diversos processos industriais e laboratoriais. Sua estrutura molecular é composta por um átomo de hidrogênio ligado a um átomo de cloro, formando uma ligação covalente polar.
Quando manipulado de forma inadequada, o ácido clorídrico pode representar riscos à saúde e ao meio ambiente. Por isso, é fundamental aprender a utilizá-lo de forma segura e eficaz em processos específicos. Um dos principais cuidados a serem tomados é utilizar equipamentos de proteção individual, como luvas, óculos de proteção e avental, para evitar o contato direto com a substância.
Além disso, é importante manipular o ácido clorídrico em ambientes bem ventilados, a fim de evitar a inalação de seus vapores corrosivos. Em caso de derramamento ou contato com a pele, é essencial agir rapidamente, lavando a área afetada com água em abundância e procurando assistência médica, se necessário.
O ácido clorídrico é amplamente utilizado na indústria química, sendo empregado na produção de PVC, na limpeza de metais e na regulação do pH de soluções. Em laboratórios, é utilizado em análises químicas e na preparação de soluções padrão. Sua versatilidade e eficácia fazem dele uma substância indispensável em diversos processos.
Em resumo, é fundamental aprender a utilizar o ácido clorídrico de forma segura e eficaz, seguindo todas as normas de segurança e manipulação. Com os devidos cuidados e conhecimentos, é possível aproveitar todos os benefícios dessa substância química em processos específicos.
Ácido clorídrico (HI): estrutura, propriedades e usos
O ácido iodídrico é uma solução aquosa de iodeto de hidrogénio, que é caracterizada pela sua elevada acidez. Uma definição mais anexada à terminologia química e ao IUPAC é que é uma hidrazida, cuja fórmula química é HI.
No entanto, para diferenciá-lo das moléculas gasosas de iodeto de hidrogênio, HI (g), é indicado como HI (ac). É por esse motivo que nas equações químicas é importante identificar o meio ou a fase física em que estão os reagentes e os produtos. Mesmo assim, confusões entre iodeto de hidrogênio e iodeto são geralmente comuns.

Se as moléculas comprometidas em sua identidade forem observadas, serão encontradas diferenças visíveis entre HI (g) e HI (ac). Em HI (g), há um link HI; enquanto em HI (ac), eles são na verdade um par de íons I – e H 3 O + interagindo eletrostaticamente (imagem acima).
Por outro lado, HI (ac) é uma fonte de HI (g), uma vez que o primeiro é preparado dissolvendo o último em água. Por esse motivo, a menos que esteja em uma equação química, o HI também pode ser usado para se referir ao ácido iodídrico. O HI é um forte agente redutor e uma excelente fonte de íons I – em meio aquoso.
Estrutura de ácido clorídrico
O ácido clorídrico, como acabamos de explicar, consiste em uma solução de HI na água. Estando na água, as moléculas HI se dissociam completamente (eletrólito forte), causando os íons I – e H 3 O + . Essa dissociação pode ser representada com a seguinte equação química:
HI (g) + H 2 O (l) => I – (aq) + H 3 O + (aq)
O que seria equivalente se fosse escrito como:
HI (g) + H 2 O (l) => HI (aq)
No entanto, HI (ac) não revela absolutamente o que aconteceu com as moléculas gasosas de HI; Apenas indica que eles estão em meio aquoso.
Portanto, a verdadeira estrutura de HI (ac) consiste nos íons I – e H 3 O + cercados por moléculas de água que os hidratam; Quanto mais concentrado o ácido clorídrico, menor o número de moléculas de água sem protonação.
Comercialmente, de fato, a concentração de HI é de 48 a 57% em água; mais concentrado seria equivalente a um excesso de fumar (e ainda mais perigoso) ácido.
Na imagem, pode-se observar que o ânion I – é representado por uma esfera roxa e H 3 O + por esferas brancas e uma vermelha por átomo de oxigênio. O cátion H 3 O + possui geometria molecular de pirâmide trigonal (vista de um plano superior na imagem).
Propriedades
Descrição física
Líquido incolor; mas pode exibir tons amarelados e marrons se estiver em contato direto com o oxigênio. Isso ocorre porque os íons I – acabam oxidando em iodo molecular, I 2 . Se houver muito I 2 , o ânion tri-iodeto I 3 – , que mancha a solução marrom, é mais do que provável .
Massa molecular
127,91 g / mol.
Cheiro
Acre.
Densidade
A densidade é de 1,70 g / mL para a solução HI a 57%; desde então, as densidades variam dependendo das diferentes concentrações de HI. Nesta concentração, forma-se um azeótropo (é destilado como uma substância única e não como uma mistura) cuja estabilidade relativa pode ser devida à sua comercialização sobre outras soluções.
Ponto de ebulição
O azeótropo HI a 57% ferve a 127 ° C a uma pressão de 1,03 bar (GO TO ATM).
pKa
-1,78.
Acidez
É um ácido extremamente forte, tanto que é corrosivo para todos os metais e tecidos; mesmo para borrachas.
Isso ocorre porque a ligação HI é muito fraca e se quebra facilmente durante a ionização na água. Além disso, as ligações de hidrogênio I – – HOH 2 + são fracas, portanto não há nada que interfira com a reação de H 3 O + com outros compostos; isto é, o H 3 O + foi “livre”, assim como o I – que não atrai muita força para seu contra-íon.
Agente redutor
O HI é um poderoso agente redutor, cujo principal produto da reação é I 2 .
Nomenclatura
A nomenclatura do ácido iodídrico deriva do fato de o iodo “funcionar” com um único estado de oxidação: -1. Além disso, o mesmo nome indica que ele possui água dentro de sua fórmula estrutural [I – ] [H 3 O + ]. Esse é seu único nome, pois não é um composto puro, mas uma solução.
Usos
Fonte de iodo na síntese orgânica e inorgânica
HI é uma excelente fonte de iões I – para a síntese inorgânica e orgânica, e é também um potente agente de redução. Por exemplo, a solução aquosa é usado 57% para a síntese de iodetos de alquilo (tal como CH 3 CH 2 I) a partir de álcoois primários. Você também pode substituir um grupo OH em uma estrutura por um I.
Agente redutor
O ácido clorídrico tem sido usado para reduzir, por exemplo, carboidratos. Se a glicose dissolvida nesse ácido for aquecida, ela perderá todos os seus grupos OH, obtendo como produto o hidrocarboneto n-hexano.
Também foi utilizado para reduzir os grupos funcionais de folhas de grafeno, para que possam ser funcionalizadas para dispositivos eletrônicos.
Processo cativa
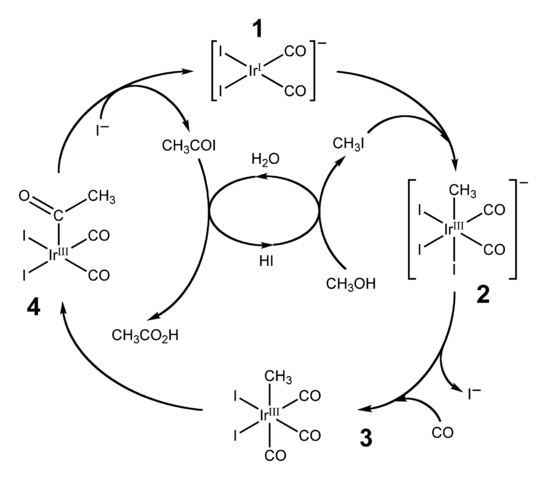
Passos
O processo começa (1) com o complexo organo-irídio [Ir (CO) 2 I 2 ] – , de geometria de plano quadrado. Este composto “recebe” iodeto de metilo, CH 3 I, acidificação do produto CH 3 OH, com 57% HI. A água também é produzida nessa reação e, graças a ela, o ácido acético é obtido no final, permitindo a recuperação do HI na última etapa.
Nesta etapa, os grupos –CH 3 e –I se juntam ao centro de metal irídio (2), formando um complexo octaédrico com uma faceta composta por três ligantes I. Um dos iodos acaba sendo substituído por uma molécula de monóxido de carbono , CO; e agora (3), o complexo octaédrico possui uma faceta composta por três ligantes de CO.
Em seguida, ocorre um rearranjo: grupo -CH 3 é “solto” Ir e junta-se ao CO adjacente (4) para formar um grupo acetilo, COCH 3 . Este grupo é libertado a partir do complexo de irídio para se ligar a iões e iodetos dar CH 3 COI, iodeto de acetilo. Aqui o catalisador de irídio é recuperado, pronto para participar de outro ciclo catalítico.
Finalmente, CH 3 COI sofre uma substituição eu – por uma molécula de H 2 O, o qual vem mecanismo de libertação de ácido acético e HI.
Síntese ilegal
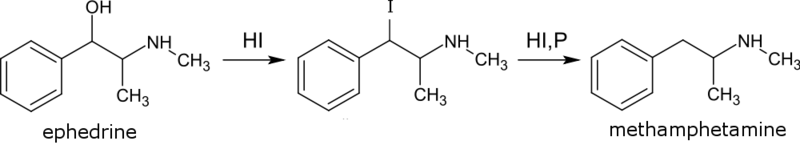
Pode-se observar que primeiro ocorre uma substituição do grupo OH por I, seguida por uma segunda substituição por um H.
Referências
- Wikipedia (2019). Ácido hidroiódico Recuperado de: en.wikipedia.org
- Andrews, Natalie. (24 de abril de 2017). Os usos do ácido hidriódico. Sciencing Recuperado de: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Ácido iodídrico Recuperado de: alfa.com
- Centro Nacional de Informação Biotecnológica. (2019). Ácido iodídrico PubChem Database., CID = 24841. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger (2017). Glossário Ilustrado de Química Orgânica: Ácido hidroiódico. Recuperado de: chem.ucla.edu
- Reusch William. (5 de maio de 2013). Carboidratos Recuperado de: 2.chemistry.msu.edu
- Em Kyu Moon, Junghyun Lee, Rodney S. Ruoff e Hyoyoung Lee. (2010). Óxido de grafeno reduzido por grafitização química. DOI: 10.1038 / ncomms1067.