Os álcoois secundários são compostos orgânicos que possuem um grupo hidroxila ligado a um átomo de carbono que, por sua vez, está ligado a outros dois átomos de carbono. Essa estrutura confere propriedades únicas a esses compostos, tornando-os amplamente utilizados em diversas áreas, como na indústria química, farmacêutica e cosmética. A nomenclatura dos álcoois secundários segue regras específicas da IUPAC, facilitando a identificação e comunicação desses compostos. Além disso, os álcoois secundários são utilizados como solventes, intermediários em sínteses orgânicas, ingredientes em produtos de beleza e higiene, entre outras aplicações. Neste contexto, é importante compreender a estrutura, propriedades, nomenclatura e usos dos álcoois secundários para explorar ao máximo o potencial desses compostos na química moderna.
Significado e características do álcool secundário: tudo o que você precisa saber.
O álcool secundário é uma classe de compostos orgânicos que possuem um grupo hidroxila ligado a um átomo de carbono secundário, ou seja, este átomo de carbono está ligado a dois outros átomos de carbono. Essa característica confere propriedades únicas a esses compostos, tornando-os importantes tanto na indústria quanto na química orgânica.
Em relação à sua estrutura, o álcool secundário é representado pela fórmula geral R2CHOH, onde R representa um grupo alquila. Essa estrutura pode apresentar diferentes arranjos espaciais, o que influencia suas propriedades físicas e químicas.
As propriedades dos álcoois secundários incluem pontos de fusão e ebulição mais altos do que os álcoois primários, devido à presença do grupo alquila ligado ao átomo de carbono secundário. Além disso, esses compostos são mais estáveis do que os álcoois primários, o que os torna mais utilizados em sínteses orgânicas.
Na nomenclatura dos álcoois secundários, o sufixo “-ol” é acrescentado ao nome do hidrocarboneto que corresponde à cadeia principal. Quando há ramificações na cadeia, essas são numeradas de forma a atribuir o menor número possível ao átomo de carbono que está ligado ao grupo hidroxila.
Os álcoois secundários têm diversos usos, sendo empregados na produção de solventes, na fabricação de produtos químicos e na indústria farmacêutica, entre outros. Sua versatilidade e estabilidade fazem com que sejam amplamente utilizados em diferentes aplicações.
Nomenclatura do álcool: como identificar corretamente os compostos alcoólicos em substâncias químicas.
A nomenclatura dos álcoois segue uma regra simples, que consiste em adicionar o sufixo -ol ao nome do hidrocarboneto correspondente. Por exemplo, o álcool derivado do etano é conhecido como etanol. Esta nomenclatura ajuda a identificar corretamente os compostos alcoólicos em substâncias químicas, facilitando a comunicação entre os profissionais da área.
Álcool secundário: estrutura, propriedades, nomenclatura, usos.
Os álcoois secundários são aqueles em que o grupo hidroxila está ligado a um carbono secundário. Sua estrutura é representada pela fórmula geral R2CHOH, onde R representa um grupo alquila. As propriedades dos álcoois secundários podem variar dependendo do grupo alquila presente na molécula.
A nomenclatura dos álcoois secundários segue a mesma regra dos álcoois em geral, ou seja, adiciona-se o sufixo -ol ao nome do hidrocarboneto correspondente. Por exemplo, o álcool secundário derivado do propano é conhecido como propan-2-ol. Esta nomenclatura ajuda a identificar corretamente os álcoois secundários e distinguir sua posição na cadeia carbônica.
Os álcoois secundários são amplamente utilizados na indústria química, principalmente como solventes em processos de extração e purificação. Além disso, também são empregados na fabricação de produtos farmacêuticos, cosméticos e bebidas alcoólicas.
Características e propriedades do álcool: o que você precisa saber sobre essa substância.
O álcool secundário é uma classe de compostos orgânicos que possuem um grupo funcional hidroxila ligado a um átomo de carbono que, por sua vez, está ligado a dois outros átomos de carbono. Essa estrutura molecular confere ao álcool secundário propriedades únicas e diversas aplicações na indústria e na química orgânica.
Em termos de nomenclatura, os álcoois secundários são nomeados de acordo com a cadeia principal de carbonos, seguido do sufixo “-ol” para indicar a presença do grupo hidroxila ligado a um carbono secundário. Por exemplo, o álcool secundário mais simples, com três carbonos na cadeia principal, é chamado de propan-2-ol.
As propriedades físicas dos álcoois secundários variam de acordo com o tamanho da cadeia carbônica e a presença de ramificações. Em geral, essas substâncias possuem pontos de fusão e ebulição mais altos do que os álcoois primários, devido à maior força de interação entre as moléculas causada pela presença do grupo hidroxila ligado a um carbono secundário.
Os álcoois secundários são amplamente utilizados na indústria química como solventes, intermediários na síntese de produtos químicos e na produção de resinas e plásticos. Além disso, essas substâncias também são empregadas na fabricação de produtos de limpeza, cosméticos e medicamentos.
Em resumo, os álcoois secundários são compostos orgânicos com uma estrutura molecular característica, propriedades físicas distintas e diversas aplicações na indústria e na química orgânica. É importante compreender a nomenclatura, as propriedades e os usos dessas substâncias para explorar todo o seu potencial em diferentes campos de aplicação.
Estrutura que caracteriza um álcool na química orgânica.
Os álcoois são compostos orgânicos que possuem em sua estrutura um grupo funcional hidroxila (-OH) ligado a um carbono saturado. Os álcoois secundários são aqueles em que o carbono ligado ao grupo hidroxila está ligado a dois outros átomos de carbono. Isso confere a eles algumas propriedades únicas e distintas.
Em relação à nomenclatura, os álcoois secundários são nomeados da seguinte forma: primeiro indica-se a posição do grupo hidroxila na cadeia principal, seguido do nome do radical ligado ao carbono onde está presente o grupo hidroxila, acrescentando o sufixo -ol. Por exemplo, o álcool secundário com um grupo hidroxila ligado ao segundo carbono em uma cadeia de quatro carbonos, ligado a um grupo metil, seria nomeado como 2-metilbutanol.
As propriedades físicas dos álcoois secundários incluem ponto de ebulição mais elevado em comparação com os alcanos de massa molar semelhante, devido às forças de atração intermoleculares mais intensas causadas pela presença do grupo hidroxila. Além disso, os álcoois secundários são solúveis em água em virtude da capacidade do grupo hidroxila de formar pontes de hidrogênio com as moléculas de água.
Quanto aos usos, os álcoois secundários têm diversas aplicações industriais, sendo utilizados como solventes, intermediários na síntese de compostos orgânicos, na produção de produtos químicos e na fabricação de cosméticos e produtos de higiene pessoal.
Em resumo, os álcoois secundários são compostos orgânicos que possuem um grupo hidroxila ligado a um carbono que, por sua vez, está ligado a dois outros átomos de carbono. Suas propriedades e aplicações fazem deles componentes importantes na química orgânica e na indústria em geral.
Álcool secundário: estrutura, propriedades, nomenclatura, usos
Um álcool secundário possui o carbono contendo o grupo hidroxila (OH), ligado a dois carbonos. Enquanto isso, no álcool primário, o carbono contendo o grupo hidroxila é ligado a um átomo de carbono, e no álcool terciário, ligado a três átomos de carbono.
Os álcoois são ácidos levemente mais fracos que a água, com o seguinte pKa: água (15.7); álcoois metil (15.2), etil (16), isopropil (álcool secundário, 17) e terbutil (18). Como pode ser visto, o álcool isopropílico é menos ácido que os álcoois metílico e etílico.

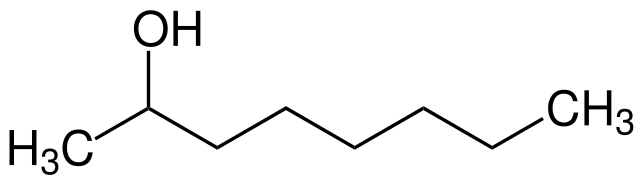
A fórmula estrutural para um álcool secundário é mostrada na imagem acima. O carbono vermelho é o transportador de OH e está ligado a dois grupos R alquil (ou aril) R e a um único átomo de hidrogênio.
Todos os álcoois têm a fórmula genérica ROH; mas se observado em detalhe portador de carbono, os álcoois primários, em seguida, (RCH obtido 2 OH), secundário (R 2 CHOH, levantada aqui), e terciária (R 3 COH). Esse fato faz diferença nas propriedades físicas e na reatividade.
Estrutura de um álcool secundário
As estruturas dos álcoois dependem da natureza dos grupos R. No entanto, para os álcoois secundários, é possível exemplificar, considerando que só pode haver estruturas lineares com ou sem ramificações ou estruturas cíclicas. Por exemplo, você tem a seguinte imagem:
Observe que para ambas as estruturas há algo em comum: OH está vinculado a um “V”. Cada extremidade do V representa um grupo R igual (parte superior da imagem, estrutura cíclica) ou diferente (parte inferior, cadeia ramificada).
Dessa maneira, qualquer álcool secundário é facilmente identificado, mesmo que sua nomenclatura seja desconhecida.
Propriedades
Pontos de ebulição
As propriedades dos álcoois secundários fisicamente não diferem muito de outros álcoois. Eles geralmente são líquidos transparentes e, para ser um sólido à temperatura ambiente, você precisa formar várias ligações de hidrogênio e ter alta massa molecular.
No entanto, a mesma fórmula estrutural R 2 CHOH sugere certas propriedades únicas em geral para estes álcoois. Por exemplo, o grupo OH é menos expostos e disponíveis para interacções por pontes de hidrogénio, R 2 CH-OH-OACDH 2 .
Isso ocorre porque os grupos R, adjacentes ao carbono portador do OH, podem interpor-se e dificultar a formação de ligações de hidrogênio. Como resultado, os álcoois secundários têm pontos de ebulição mais baixos que os álcoois primários (RCH 2 OH).
Acidez
De acordo com a definição de Brönsted-Lowry, um ácido é aquele que doa prótons ou íons hidrogênio, H + . Quando isso acontece com um álcool secundário, você tem:
R 2 CHOH + B – => R 2 CHO – + HB
A base conjugada de R 2 CHO – , anião alcóxido, para estabilizar a carga negativa. Para o álcool secundário, a estabilização é menor, pois os dois grupos R têm densidade eletrônica, que repele em certa medida a carga negativa no átomo de oxigênio.
Enquanto que, para o anião alcóxido de um álcool primário, RCH 2 O – , não é menos de repulsão de electrões possuindo um e apenas um grupo R e não dois. Além disso, os átomos de hidrogênio não exercem uma repulsão significativa e, pelo contrário, contribuem para estabilizar a carga negativa.
Portanto, os álcoois secundários são menos ácidos que os álcoois primários. Se é assim, então eles são mais básicos e precisamente pelos mesmos motivos:
R 2 CHOH + H 2 B + => R 2 CHOH 2 + + HB
Agora, os grupos R estabilizam a carga positiva no oxigênio, abandonando parte de sua densidade eletrônica.
Reacções
Halogeneto de hidrogênio e trihalogeneto de fósforo
Um álcool secundário pode reagir com um halogeneto de hidrogênio. A equação química da reação entre álcool isopropílico e ácido bromídrico, em meio sulfúrico, e produzindo brometo de isopropil é mostrada:
CH 3 CHOHCH 3 + HBr => CH 3 CHBrCH 3 + H 2 O
E também pode reagir com um trihalogenuero de fósforo, PX 3 (X = Br, I):
CH 3 -CHOH-CH 2 -CH 2 -CH 3 + PBr 3 => CH3-CHBr-CH 2 -CH 2 -CH 3 + H 3 PO 3
A equação química acima corresponde à reação entre Sec-pentanol e tribrometo de fósforo, causando brometo de sec-pentil.
Note-se que em ambas as reacções halogeneto (R alquilo secundário ocorre duas CHX).
Desidratação
Nesta reação, um H e um OH dos carbonos vizinhos são perdidos, formando uma ligação dupla entre esses dois átomos de carbono. Portanto, há a formação de um alceno. A reação requer um catalisador ácido e fornecimento de calor.
Álcool => Alceno + H 2 S
Por exemplo, você tem a seguinte reação:
Ciclohexanol => Ciclohexeno + H 2 S
Reação com metais ativos
Álcoois secundários podem reagir com metais:
CH 3 -CHOH-CH 3 + K => CH 3 CHO – K + CH 3 + ½ H +
Aqui o álcool isopropílico reage com o potássio para formar o sal isoproxido de potássio e os íons hidrogênio.
Esterificação
O álcool secundário reage com um ácido carboxílico para causar um éster. Por exemplo, a equação química da reação do álcool sec-butílico com ácido acético é mostrada para produzir acetato de sec-butil:
CH 3 CHOHCH 2 CH 3 + CH 3 COOH <=> CH 3 COOCHCH 3 CH 2 CH 3
Oxidação
Os álcoois primários são oxidados em aldeídos , e estes, por sua vez, são oxidados em ácidos carboxílicos. Mas os álcoois secundários oxidam em acetona. As reações são geralmente catalisadas por dicromato de potássio (K 2 CrO 7 ) e ácido crômico (H 2 CrO 4 ).
A reação geral é:
R 2 CHOH => R 2 C = O
Nomenclatura
Os álcoois secundários são nomeados indicando a posição do grupo OH na cadeia principal (mais longa). Esse número precede o nome ou pode seguir o nome do respectivo alcano para essa cadeia.
Por exemplo, CH 3 CH 2 CH 2 CH 2 CHOHCH 3 , 2-hexanol é ou hexan-2-ol.
Se a estrutura é cíclica, não há necessidade de colocar um numerador; a menos que haja outros substituintes. É por isso que o álcool cíclico na segunda imagem é chamado ciclohexanol (o anel é hexagonal).
E para o outro álcool da mesma imagem (o ramificado), seu nome é: 6-etil-heptan-2-ol.
Usos
-Secon-butanol é usado como solvente e produto químico intermediário. Está presente em fluidos de freio hidráulico, produtos de limpeza industriais, branqueadores, decapantes, agentes de flotação mineral e essências de frutas e perfumes.
-O álcool isopropanol é usado como solvente industrial e como anticoagulante. É usado em óleos e tintas de secagem rápida, como anti-séptico e substituto do etanol em cosméticos (por exemplo: loções para a pele, tônicos para os cabelos e álcool).
-Isopropanol é um ingrediente em sabonetes líquidos, limpadores de vidro, sabores sintéticos de bebidas não alcoólicas e alimentos. Além disso, é um produto químico intermediário.
-Ciclohexanol é usado como solvente, no acabamento de tecidos, no processamento de couro e emulsificante de sabões e detergentes sintéticos.
-O metilciclohexanol é um ingrediente no removedor de manchas à base de sabão e nos detergentes para tecidos especiais.
Exemplos
2-octanol
É um álcool gordo. É um líquido incolor, pouco solúvel em água, mas solúvel na maioria dos solventes não polares. É utilizado, entre outros usos, na elaboração de sabores e fragrâncias, tintas e revestimentos, tintas, adesivos, produtos para o lar e lubrificantes.
Estradiol ou 17β-estradiol
É um hormônio sexual esteróide. Possui dois grupos hidroxila em sua estrutura. É o estrogênio predominante durante os anos reprodutivos.
20-hidroxi-leucotrieno
É um metabólito que provavelmente se origina da oxidação do lipídeo leucotrieno. É classificado como um leucotrieno cistinil. Esses compostos são mediadores do processo inflamatório que contribui para as características fisiopatológicas da rinite alérgica.
2-Heptanol
É um álcool encontrado em frutas. Além disso, é encontrado no óleo de gengibre e nos morangos. É transparente, incolor e insolúvel em água. É usado como solvente de várias resinas e está envolvido na fase de flotação no processamento mineral.
Referências
- James (17 de setembro de 2014). Álcoois (1) – Nomenclatura e Propriedades. Recuperado de: masterorganicchemistry.com
- Enciclopédia de Saúde e Segurança no Trabalho. (sf). Álcoois [PDF]. Recuperado de: insht.es
- Clark J. (16 de julho de 2015). Estrutura e Classificação de Álcoois. Libretexts de Química. Recuperado de: chem.libretexts.org
- PubChem (2019). 20-hidroxi-leucotrieno E4. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Morrison, RT e Boyd, R., N. (1987). Quimica Organica. 5 ta Edition. Editorial Addison-Wesley Interamerican.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill
- Graham Solomons TW, Craig B. Fryhle. (2011). Química Orgânica Aminas (10 ª edição). Wiley Plus
- Wikipedia (2018). 2-octanol. Recuperado de: en.wikipedia.org