O modelo atômico de Broglie, proposto pelo físico francês Louis de Broglie em 1924, é uma teoria que descreve o comportamento ondulatório das partículas subatômicas, como elétrons, prótons e nêutrons. Segundo essa teoria, as partículas possuem características de onda, o que significa que elas podem se comportar tanto como partículas quanto como ondas.
No entanto, o modelo atômico de Broglie também apresenta algumas limitações. Por exemplo, ele não consegue explicar completamente o comportamento das partículas em certas circunstâncias, como em situações de alta energia ou quando as partículas estão sujeitas a forças externas. Além disso, a interpretação do modelo atômico de Broglie pode ser complexa e requer um entendimento profundo da física quântica.
Apesar de suas limitações, o modelo atômico de Broglie ainda é uma ferramenta importante para a compreensão do comportamento das partículas subatômicas e tem sido fundamental para o desenvolvimento da física moderna.
Qual foi a inovação proposta por De Broglie na teoria quântica?
No Modelo atômico de De Broglie, uma das principais inovações propostas pelo físico francês Louis de Broglie foi a introdução da ideia de que as partículas, como elétrons, podem se comportar não apenas como partículas, mas também como ondas. Essa dualidade onda-partícula foi fundamental para o desenvolvimento da teoria quântica, pois permitiu uma nova compreensão do comportamento dos elétrons nos átomos.
Qual foi a proposta de De Broglie em relação à natureza dual das partículas?
A proposta de De Broglie em relação à natureza dual das partículas foi a de que todas as partículas, como elétrons e prótons, possuem características tanto de partícula quanto de onda. Isso significa que as partículas podem exibir comportamentos de onda, como interferência e difração, além de se comportarem como partículas com massa e carga.
De acordo com a teoria de De Broglie, as partículas possuem uma comprimento de onda associado a elas, o que sugere que a matéria pode se comportar de maneira semelhante à luz, que é composta por fótons. Essa ideia revolucionária abriu caminho para o desenvolvimento da mecânica quântica e influenciou profundamente a compreensão da natureza da matéria.
Essa proposta foi fundamental para o desenvolvimento do modelo atômico de Broglie, que incorporou a dualidade onda-partícula das partículas subatômicas. Esse modelo permitiu uma melhor compreensão do comportamento dos elétrons nos átomos, explicando fenômenos como a estabilidade dos átomos e a formação de espectros atômicos.
Apesar de suas contribuições significativas, o modelo atômico de Broglie também apresenta algumas limitações. Por exemplo, ele não consegue explicar completamente certos fenômenos observados em níveis subatômicos, como o comportamento dos elétrons em sistemas complexos. Além disso, a interpretação da dualidade onda-partícula ainda gera debates e questões em aberto na física moderna.
Conceito de De Broglie: a dualidade onda-partícula na física quântica.
O conceito de De Broglie, proposto pelo físico Louis de Broglie em 1924, introduziu a ideia de que partículas como elétrons e prótons podem se comportar tanto como partículas quanto como ondas. Essa dualidade onda-partícula na física quântica foi um marco revolucionário que desafiou a visão clássica da física e abriu novas perspectivas para a compreensão do mundo subatômico.
De acordo com a teoria de De Broglie, todas as partículas possuem uma natureza ondulatória, com comprimentos de onda associados a elas. Isso significa que, assim como as ondas de luz podem se comportar como partículas em certas situações, as partículas também podem exibir propriedades ondulatórias. Esse conceito fundamental da física quântica foi posteriormente confirmado por experimentos como o experimento de difração de elétrons.
Modelo atômico de Broglie: recursos e limitações.
O modelo atômico de Broglie incorpora a dualidade onda-partícula na descrição dos átomos e suas partículas constituintes. Ele oferece uma visão mais abrangente e unificada do comportamento das partículas no nível subatômico, permitindo uma melhor compreensão de fenômenos como a difração de elétrons e a formação de padrões de interferência.
No entanto, o modelo de Broglie também apresenta limitações, especialmente quando se trata de descrever sistemas complexos ou interações entre múltiplas partículas. Além disso, a interpretação da dualidade onda-partícula ainda levanta questões filosóficas e conceituais sobre a verdadeira natureza da realidade quântica.
Princípio da dualidade: proposta de De Broglie sobre natureza ondulatória e corpuscular da matéria.
O Princípio da dualidade é uma importante ideia proposta por De Broglie que sugere que a matéria possui tanto características ondulatórias quanto corpusculares. De acordo com essa teoria, partículas como elétrons e prótons podem se comportar como ondas em certas situações, além de apresentarem suas propriedades corpusculares tradicionais.
O Modelo atômico de Broglie leva em consideração essa dualidade e propõe uma nova maneira de entender a estrutura dos átomos. De acordo com De Broglie, os elétrons ao redor do núcleo atômico podem ser vistos como ondas estacionárias, em vez de partículas em órbita fixa. Isso ajuda a explicar fenômenos como a difração de elétrons e a formação de padrões de interferência em experimentos de dupla fenda.
Apesar de oferecer uma nova perspectiva sobre a natureza da matéria, o Modelo atômico de Broglie apresenta algumas limitações. Por exemplo, a aplicação prática dessa teoria em sistemas complexos pode ser desafiadora, e alguns experimentos não conseguem fornecer evidências claras da dualidade onda-partícula. Além disso, a interpretação dos resultados obtidos com base nesse modelo pode ser complicada e controversa.
Em resumo, o Princípio da dualidade proposto por De Broglie desempenha um papel fundamental na nossa compreensão da natureza da matéria, permitindo-nos abordar a dualidade onda-partícula de maneira mais ampla. Apesar das limitações do Modelo atômico de Broglie, ele continua a ser uma ferramenta valiosa na exploração dos fenômenos quânticos e na evolução da física moderna.
Modelo atômico de Broglie: recursos e limitações
O modelo atômico Broglie foi proposto pelo físico francês Louis de Broglie em 1924. Em sua tese de doutorado, disse dualidade Broglie onda-partícula dos elétrons, que estabelece a base da mecânica ondulatória. Broglie publicou importantes descobertas teóricas sobre a natureza corpórea das ondas da matéria na escala atômica.
Posteriormente, as declarações de Broglie foram demonstradas experimentalmente pelos cientistas Clinton Davisson e Lester Germer em 1927. A teoria das ondas elétricas de Broglie é baseada na proposta de Einstein sobre as propriedades das ondas da luz em comprimentos de onda curtos.

Broglie anunciou a possibilidade de que a matéria tivesse um comportamento semelhante ao da luz e sugeriu propriedades semelhantes em partículas subatômicas, como elétrons.
Cargas e órbitas elétricas restringem a amplitude, comprimento e frequência da onda descrita pelos elétrons. Broglie explicou o movimento dos elétrons ao redor do núcleo atômico.
Características do modelo atômico de Broglie
Para desenvolver sua proposta, Broglie partiu do princípio de que os elétrons tinham uma natureza dupla entre onda e partícula, semelhante à luz.
Nesse sentido, Broglie fez uma comparação entre os dois fenômenos e, com base nas equações desenvolvidas por Einstein para o estudo da natureza das ondas da luz, indicou o seguinte:
– A energia total do fóton e, consequentemente, a energia total do elétron, resulta do produto da frequência das ondas e da constante de Plank (6.62606957 (29) × 10 -34 Jules x segundos), como detalhes na seguinte expressão:
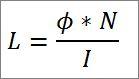
Nesta expressão:
E = energia eletrônica.
h = constante da prancha.
f = frequência de onda.
– O momento linear do fóton e, portanto, do elétron, é inversamente proporcional ao comprimento de onda, e ambas as magnitudes são relacionadas através da constante Plank:
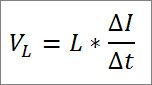
Nesta expressão:
p = momento linear do elétron.
h = constante da prancha.
λ = comprimento de onda.
– O momento linear é o produto da massa da partícula pela velocidade que a partícula possui durante seu deslocamento.
Se a expressão matemática anterior for reestruturada com base no comprimento de onda, será feito o seguinte:
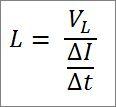
Nessa expressão:
λ = comprimento de onda.
h = constante da prancha.
m = massa do elétron.
v = velocidade do elétron.
Como h, a constante da prancha, tem um valor pequeno, o comprimento de onda λ também é. Consequentemente, é possível afirmar que as propriedades das ondas de elétrons ocorrem apenas nos níveis atômico e subatômico.
– Broglie também se baseia nos postulados do modelo atômico de Bohr. De acordo com este último, as órbitas dos elétrons são limitadas e podem ser apenas múltiplos de números inteiros. Assim:

Onde:
λ = comprimento de onda.
h = constante da prancha.
m = massa do elétron.
v = velocidade do elétron.
r = raio da órbita.
n = inteiro
De acordo com o modelo atômico de Bohr, adotado por Broglie como base, se os elétrons se comportam como ondas estacionárias, as únicas órbitas permitidas são aquelas cujo raio é igual a um múltiplo inteiro do comprimento de onda λ.
Portanto, nem todas as órbitas atendem aos parâmetros necessários para que um elétron se mova através delas. É por isso que os elétrons só podem viajar em órbitas específicas.
A teoria das ondas de elétrons de Broglie justificou o sucesso do modelo atômico de Bohr para explicar o comportamento do elétron único no átomo de hidrogênio.
Da mesma forma, também esclareceu por que esse modelo não se encaixava em sistemas mais complexos, ou seja, átomos com mais de um elétron.
Experiência de Davisson e Germer
A verificação experimental do modelo atômico de Broglie ocorreu três anos após sua publicação, em 1927.
Os principais físicos americanos Clinton J. Davisson e Lester Germer confirmaram experimentalmente a teoria da mecânica das ondas.
Davisson e Germer realizaram testes de espalhamento de um feixe de elétrons através de um cristal de níquel e observaram o fenômeno de difração através do meio metálico.
O experimento foi realizar o seguinte procedimento:
– Na primeira instância, um conjunto de feixe de elétrons com uma energia inicial conhecida foi colocado.
– Uma fonte de tensão foi instalada para acelerar o movimento de elétrons incitando uma diferença de potencial.
– O fluxo do feixe de elétrons foi direcionado para um cristal metálico; Nesse caso, níquel.
– O número de elétrons que impactaram o cristal de níquel foi medido.

No final da experimentação, Davisson e Germer detectaram que os elétrons se dispersavam em direções diferentes.
Repetindo o experimento usando cristais de metal com orientações diferentes, os cientistas detectaram o seguinte:
– A dispersão do feixe de elétrons através do cristal metálico foi comparável ao fenômeno de interferência e difração dos raios de luz.
– A reflexão dos elétrons no cristal de impacto descreveu o caminho que, teoricamente, deveria ser descrito de acordo com a teoria das ondas de elétrons de Broglie.
Em síntese, o experimento de Davisson e Germer testou experimentalmente a natureza de partículas de onda dupla dos elétrons.
Limitações
O modelo atômico de Broglie não prevê a localização exata do elétron na órbita em que ele viaja.
Nesse modelo, os elétrons são percebidos como ondas que se movem pela órbita sem um local específico, o que introduz o conceito de orbital eletrônico.

Além disso, o modelo atômico de Broglie, análogo ao modelo de Schrödinger, não considera a rotação de elétrons no mesmo eixo ( rotação ).
Ao ignorar o momento angular intrínseco dos elétrons, as variações espaciais dessas partículas subatômicas estão sendo negligenciadas.
Na mesma ordem de idéias, esse modelo também não leva em consideração as mudanças no comportamento dos elétrons rápidos como resultado de efeitos relativísticos.
Artigos de interesse
Modelo atômico de Schrödinger .
Modelo atômico de Chadwick .
Modelo atômico de Heisenberg .
Modelo atômico Perrin .
Modelo atômico de Thomson .
Modelo atômico de Dalton .
Modelo atômico de Dirac Jordan .
Modelo atômico de Demócrito .
Modelo atômico de Bohr .
Referências
- Teoria Quântica de Bohr e De Broglie Waves (sf). Recuperado de: ne.phys.kyushu-u.ac.j
- Louis de Broglie – Biographical (1929). © Fundação Nobel. Recuperado de: nobelprize.org
- Louis-Victor de Broglie (sf). Recuperado de: chemed.chem.purdue.edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Recuperado de: britannica.com
- Modelo atômico de De Broglie. Universidade Nacional de Educação à Distância. Espanha Recuperado de: ocw.innova.uned.es
- Ondas De Matéria De Louis De Broglie (sf). Recuperado de: hiru.eus
- Von Pamel, O. e Marchisio, S. (sf). Mecânica Quântica Universidade Nacional de Rosário. Recuperado de: fceia.unr.edu.ar