Os subníveis de energia são regiões específicas de um átomo onde os elétrons podem ser encontrados. Eles são representados por letras do alfabeto que correspondem aos diferentes tipos de subníveis: s (sharp), p (principal), d (diffuse) e f (fundamental). Cada subnível pode conter um número máximo de elétrons, de acordo com as regras da distribuição eletrônica de Pauli e do princípio de exclusão de Pauli. A representação dos subníveis de energia é importante para entender a distribuição dos elétrons nos diferentes níveis de energia de um átomo e para prever suas propriedades químicas e físicas.
Explorando os subníveis: uma análise detalhada sobre sua estrutura e organização.
O que são subníveis de energia e como eles são representados? Para entendermos melhor os subníveis de energia, é importante primeiro relembrar que os elétrons em um átomo estão distribuídos em diferentes níveis de energia chamados de camadas. Cada camada pode ser dividida em subníveis de energia, que por sua vez são representados por letras do alfabeto: s, p, d e f.
Os subníveis de energia diferem entre si em termos de forma e orientação no espaço. O subnível s, por exemplo, é esférico e possui um único orbital, enquanto os subníveis p, d e f possuem formas mais complexas e múltiplos orbitais. A cada subnível está associado um número máximo de elétrons que podem ocupá-lo, de acordo com o princípio de exclusão de Pauli.
Para representar os subníveis de energia em um diagrama de níveis de energia, utiliza-se um esquema onde as camadas são dispostas horizontalmente e os subníveis de energia são representados verticalmente. Cada subnível é indicado pela letra correspondente e pelo número de orbitais presentes (por exemplo, 2s, 3p, 4d). Além disso, a capacidade de cada subnível para abrigar elétrons é indicada pelo número de elétrons em cada orbital.
Em resumo, os subníveis de energia são partes fundamentais da estrutura dos átomos, determinando a distribuição dos elétrons em torno do núcleo. Sua representação em diagramas de níveis de energia nos ajuda a visualizar e compreender a organização dos elétrons em um átomo, contribuindo para o estudo da química e da física atômica.
Subníveis de energia: quantos elétrons cabem em cada um dos 4 subníveis?
Subníveis de energia são regiões do espaço ao redor de um núcleo atômico onde a probabilidade de encontrar elétrons é maior. Cada subnível é representado por uma letra s, p, d ou f, e cada um desses subníveis tem capacidade para um número específico de elétrons.
No subnível s, cabem no máximo 2 elétrons. No subnível p, cabem até 6 elétrons. Já no subnível d, a capacidade é de 10 elétrons, e no subnível f, podem ser acomodados até 14 elétrons.
Esses subníveis são representados através de diagramas de Lewis ou da Tabela Periódica, onde cada elemento químico é disposto de acordo com a distribuição dos elétrons em seus subníveis de energia.
Entender os subníveis de energia é fundamental para compreender a estrutura dos átomos e as propriedades dos elementos químicos. A distribuição dos elétrons nos subníveis influencia diretamente o comportamento dos átomos em reações químicas e em diversas interações químicas.
Quais são os tipos de subníveis existentes na física quântica?
Na física quântica, os subníveis de energia são as regiões do átomo onde os elétrons são mais prováveis de serem encontrados. Existem quatro tipos de subníveis principais: s, p, d e f.
Os subníveis s possuem forma esférica e podem conter até 2 elétrons. Já os subníveis p têm forma de halteres e podem conter até 6 elétrons. Os subníveis d têm forma de quatro folhas e podem conter até 10 elétrons, enquanto os subníveis f têm forma complexa e podem conter até 14 elétrons.
Os subníveis são representados por números quânticos. O número quântico principal (n) indica o nível de energia do elétron, enquanto o número quântico secundário (l) indica o tipo de subnível. Por exemplo, o subnível s tem l=0, o subnível p tem l=1, o subnível d tem l=2 e o subnível f tem l=3.
Em resumo, os subníveis de energia na física quântica são os locais onde os elétrons se distribuem ao redor do núcleo do átomo. Eles são representados por letras (s, p, d, f) e números quânticos (n e l) que indicam suas características e capacidade de conter elétrons.
Identificando os subníveis da camada eletrônica: saiba quais são e suas características.
Os subníveis de energia são divisões da camada eletrônica de um átomo que indicam os diferentes locais onde os elétrons podem ser encontrados. Eles são representados pelas letras s, p, d e f, cada uma com suas próprias características.
O subnível s é esférico e pode conter até 2 elétrons. O subnível p é em forma de halteres e pode conter até 6 elétrons. Já o subnível d é em forma de cruz e pode conter até 10 elétrons. Por fim, o subnível f é mais complexo e pode conter até 14 elétrons.
Estes subníveis são importantes para determinar a distribuição dos elétrons ao redor do núcleo do átomo. Cada subnível tem uma capacidade máxima de elétrons que pode abrigar, de acordo com o princípio de Pauli e o princípio da exclusão de Pauli.
Portanto, conhecer os subníveis de energia e suas características é fundamental para entender a estrutura eletrônica dos átomos e prever seu comportamento químico. É importante ressaltar que a distribuição dos elétrons nos subníveis segue um padrão específico, que pode ser determinado a partir da configuração eletrônica do átomo.
O que são subníveis de energia e como eles são representados?
Os subníveis de energia no átomo são a maneira pela qual os elétrons são organizados nas camadas eletrônicas, sua distribuição na molécula ou átomo. Esses subníveis de energia são chamados orbitais.
A organização dos elétrons nos subníveis é o que permite combinações químicas de átomos diferentes e também define sua posição na Tabela Periódica dos Elementos.

Os elétrons são dispostos nas camadas de elétrons do átomo de uma certa maneira por uma combinação de estados quânticos. No momento em que um desses estados é ocupado por um elétron, os outros elétrons devem estar localizados em um estado diferente.
1. Introdução

Cada elemento químico da tabela periódica consiste em átomos, que por sua vez são compostos de nêutrons, prótons e elétrons. Os elétrons são partículas carregadas negativamente que são encontradas ao redor do núcleo de qualquer átomo, distribuídas nos orbitais dos elétrons.
Orbitais de elétrons são o volume de espaço em que um elétron tem 95% de chance de existir. Existem diferentes tipos de orbitais, com formas diferentes. No máximo dois elétrons podem ser localizados em cada orbital. O primeiro orbital de um átomo é onde existe a maior probabilidade de encontrar elétrons.
Os orbitais são designados com as letras s, p, dyf, que são Nítidas, Princípio, Difusa e Fundamental e combinam quando átomos são unidos para formar uma molécula maior. Em cada camada do átomo existem essas combinações de orbitais.
Por exemplo, na camada 1 do átomo estão os orbitais S, na camada 2 existem orbitais S e P, na camada 3 do átomo existem orbitais S, P e D e, finalmente, na camada 4 do átomo estão todos orbitais S, P, D e F.
Também nos orbitais encontramos diferentes subníveis, que por sua vez podem armazenar mais elétrons. Orbitais em diferentes níveis de energia são semelhantes entre si, mas ocupam áreas diferentes no espaço.
O primeiro orbital e o segundo orbital têm as mesmas características que um orbital S têm nós radiais, têm maior probabilidade de volume esférico e podem conter apenas dois elétrons. No entanto, eles estão localizados em diferentes níveis de energia e, portanto, ocupam diferentes espaços ao redor do núcleo.
Localização na tabela periódica de elementos
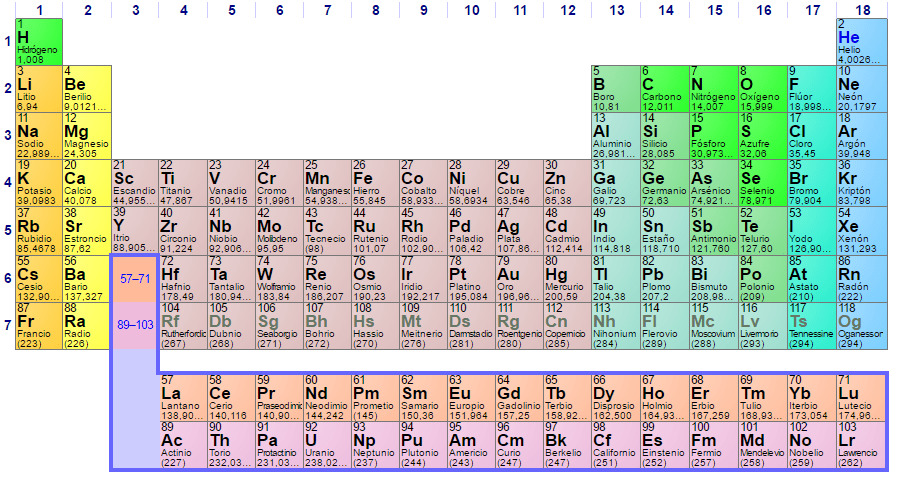
Cada uma das configurações eletrônicas dos elementos é única, e é por isso que elas determinam sua posição na tabela periódica de elementos . Essa posição é definida pelo período de cada elemento e seu número atômico pela quantidade de elétrons que o átomo do elemento possui.
Portanto, usar a tabela periódica para determinar a configuração dos elétrons nos átomos é essencial. Os elementos são divididos em grupos de acordo com suas configurações eletrônicas, como a seguir:
Cada orbital é representado em blocos específicos dentro da tabela periódica de elementos. Por exemplo, o bloco orbital S é a região dos metais alcalinos, o primeiro grupo da tabela e onde são encontrados seis elementos Lítio (Li), Rubídio (Rb), Potássio (K), Sódio (Na), Francium ( Fr) e césio (Cs) e também hidrogênio (H), que não é um metal, mas um gás.
Esse grupo de elementos possui um elétron, que geralmente é facilmente perdido para formar um íon carregado positivamente. Eles são os metais mais ativos e mais reativos.
O hidrogênio, neste caso, é um gás, mas está dentro do grupo 1 da tabela periódica de elementos, uma vez que também possui apenas um elétron. O hidrogênio pode formar íons com uma única carga positiva, mas atingir seu único elétron requer muito mais energia do que remover elétrons de outros metais alcalinos. Ao formar compostos, o hidrogênio geralmente gera ligações covalentes.
No entanto, sob pressões muito altas, o hidrogênio se torna metálico e se comporta como o resto dos elementos de seu grupo. Isso ocorre, por exemplo, dentro do núcleo do planeta Júpiter.
O grupo 2 corresponde aos metais alcalino-terrosos, pois seus óxidos possuem propriedades alcalinas. Entre os elementos desse grupo, encontramos magnésio (Mg) e cálcio (Ca). Seus orbitais também pertencem ao nível S.
Os metais de transição, que correspondem aos grupos 3 a 12 da Tabela Periódica, têm orbitais do tipo D.
Os elementos que vão do grupo 13 a 18 na tabela correspondem aos orbitais P. E, finalmente, os elementos conhecidos como lantanídeos e actinídeos têm orbitais de nome F.
Localização do elétron nos orbitais
Os elétrons são encontrados nos orbitais do átomo como uma maneira de diminuir a energia. Portanto, se eles procuram aumentar a energia, os elétrons preencherão os principais níveis orbitais, afastando-se do núcleo do átomo.
Deve-se considerar que os elétrons têm uma propriedade intrínseca conhecida como spin. Este é um conceito quântico que determina, entre outras coisas, a rotação do elétron dentro do orbital. O que é essencial para determinar sua posição nos subníveis de energia.
As regras que determinam a posição dos elétrons nos orbitais do átomo são as seguintes:
- Princípio de Aufbau: Os elétrons entram nos orbitais com menos energia primeiro. Este princípio é baseado nos diagramas dos níveis de energia de certos átomos.
- Princípio de exclusão de Pauli: Um orbital atômico pode descrever pelo menos dois elétrons. Isso significa que apenas dois elétrons com rotação eletrônica diferente podem ocupar um orbital atômico.
Isso implica que um orbital atômico é um estado energético.
- Regra de Hund: Quando os elétrons ocupam orbitais da mesma energia, os elétrons entram nos primeiros orbitais vazios. Isso significa que os elétrons preferem rotações paralelas em orbitais separados dos subníveis de energia.
Os elétrons preencherão todos os orbitais nos subníveis antes de encontrar rotações opostas.
Configurações eletrônicas especiais
Também existem átomos com casos especiais de subníveis de energia. Quando dois elétrons ocupam o mesmo orbital, eles devem não apenas ter rotações diferentes (como indicado pelo princípio de exclusão de Pauli), mas o acoplamento dos elétrons aumenta levemente a energia.
No caso de subníveis de energia, um subnível meio cheio e cheio cheio reduz a energia do átomo. Isso leva o átomo a ter maior estabilidade.
Referências
- Configuração eletrônica Recuperado da Wikipedia.com.
- Introdução às Configurações Eletrônicas. Recuperado de chem.libretexts.org.
- Orbitais e Títulos. Recuperado de chem.fsu.edu.
- Tabela periódica, principais elementos do grupo. Recuperado de newworldencyclopedia.org.
- Princípios de configuração eletro. Recuperado de sartep.com.
- Configuração Eletrônica de Elementos. Recuperado de science.uwaterloo.ca.
- Electron Spin Recuperado de hyperphysics.phy-astr.gsu.edu.