A osmolaridade é uma medida que expressa a concentração de partículas osmoticamente ativas em uma solução. Ela é calculada com base na quantidade de partículas presentes em um litro de solução e é expressa em osmoles por litro (Osm/L).
A osmolaridade é diferente da osmolalidade, que é a concentração de partículas osmoticamente ativas por quilograma de solvente. Enquanto a osmolaridade é afetada pela temperatura e pressão, a osmolalidade não sofre influência desses fatores.
Neste contexto, é importante entender como calcular a osmolaridade de uma solução e a diferença entre osmolaridade e osmolalidade para garantir um correto entendimento das propriedades das soluções em sistemas biológicos e químicos.
Qual a distinção entre osmolalidade e osmolaridade? Entenda as diferenças entre esses conceitos.
Osmolalidade e osmolaridade são termos frequentemente utilizados em química e fisiologia para descrever a concentração de partículas em uma solução. Apesar de serem conceitos semelhantes, eles possuem diferenças importantes que devem ser compreendidas.
A osmolalidade é definida como a concentração de partículas em um quilograma de solvente, enquanto a osmolaridade é a concentração de partículas em um litro de solução. Em outras palavras, a osmolalidade leva em consideração a massa do solvente, enquanto a osmolaridade considera o volume da solução.
Para calcular a osmolalidade, é necessário dividir o número de partículas presentes na solução pelo peso total do solvente em quilogramas. Já para calcular a osmolaridade, divide-se o número de partículas pela quantidade total de solução em litros.
Uma diferença prática entre os dois conceitos é que a osmolalidade é menos afetada por mudanças na temperatura, pois a massa do solvente permanece constante. Por outro lado, a osmolaridade pode variar com as alterações de temperatura, uma vez que o volume da solução pode se expandir ou contrair.
Em resumo, a osmolalidade e a osmolaridade são medidas de concentração de partículas em uma solução, sendo a primeira relacionada ao peso do solvente e a segunda ao volume da solução. É importante compreender essas diferenças para utilizar os conceitos de forma correta em diferentes contextos.
Diferença entre osmolaridade e tonicidade: entenda as distinções entre esses conceitos fundamentais em biologia.
A osmolaridade e a tonicidade são conceitos fundamentais em biologia que estão relacionados à concentração de solutos em uma solução e ao seu efeito na célula. Embora ambos estejam relacionados à pressão osmótica, eles têm significados diferentes.
A osmolaridade é uma medida da concentração total de solutos em uma solução, expressa em osmoles por litro (Osm/L). Ela leva em consideração todas as partículas presentes na solução, sejam elas íons, moléculas pequenas ou macromoléculas. Para calcular a osmolaridade de uma solução, basta somar as concentrações de todos os solutos presentes, levando em consideração sua capacidade de dissociação.
Por outro lado, a tonicidade é uma medida do potencial de uma solução em causar a saída ou entrada de água em uma célula. Ela está relacionada à concentração de solutos que não podem atravessar a membrana celular, como íons e algumas moléculas grandes. A tonicidade de uma solução pode ser classificada em hipotônica, isotônica ou hipertônica, dependendo da concentração de solutos em relação ao meio intracelular.
Em resumo, a osmolaridade se refere à concentração total de solutos em uma solução, enquanto a tonicidade está relacionada ao efeito desses solutos na pressão osmótica e na entrada ou saída de água em uma célula.
Qual a relação entre a concentração molar e a concentração osmolar em soluções aquosas?
A relação entre a concentração molar e a concentração osmolar em soluções aquosas está relacionada com a forma como as partículas se distribuem na solução. A concentração molar, representada pela unidade mol/L, é calculada pela quantidade de soluto em relação ao volume total da solução. Já a concentração osmolar, representada pela unidade osmol/L, leva em consideração não apenas a quantidade de soluto, mas também a quantidade de partículas que o soluto se dissocia, se ioniza ou se associa na solução.
Em outras palavras, a concentração osmolar leva em conta o número total de partículas presentes na solução, enquanto a concentração molar considera apenas a quantidade de soluto em relação ao volume da solução. Portanto, em soluções aquosas, a concentração osmolar pode ser diferente da concentração molar, especialmente em casos onde o soluto se dissocia em íons ou se associa em moléculas maiores.
Para calcular a osmolaridade de uma solução, é necessário levar em consideração a fórmula osmolaridade = concentração molar x fator de dissociação. O fator de dissociação é o número de partículas em que o soluto se transforma quando se dissolve na solução. Por exemplo, uma solução de NaCl (cloreto de sódio) terá um fator de dissociação de 2, pois o NaCl se dissocia em Na+ e Cl-. Portanto, a osmolaridade dessa solução será a concentração molar multiplicada por 2.
Em resumo, a relação entre a concentração molar e a concentração osmolar em soluções aquosas está na forma como as partículas se distribuem na solução, levando em consideração a quantidade de soluto e o número de partículas em que o soluto se dissocia. É importante entender essa diferença para realizar cálculos precisos e garantir a correta preparação e administração de soluções.
Fatores determinantes da osmolaridade em um organismo humano.
A osmolaridade em um organismo humano é determinada por diversos fatores que influenciam a concentração de solutos nas soluções biológicas. A osmolaridade é a medida da concentração de partículas osmoticamente ativas em uma solução, expressa em osmoles por litro de solução.
Os principais fatores que determinam a osmolaridade em um organismo humano incluem a concentração de íons, glicose, ureia e outras substâncias dissolvidas no plasma sanguíneo. A concentração dessas substâncias é regulada pelo funcionamento dos rins, que filtram o sangue e ajustam a excreção de solutos de acordo com as necessidades do corpo.
Além disso, a osmolaridade também pode ser influenciada pela ingestão de líquidos e alimentos, uma vez que a quantidade de solutos ingeridos afeta a concentração de partículas no organismo. Por exemplo, a ingestão de alimentos ricos em sódio pode aumentar a osmolaridade do plasma sanguíneo.
Outro fator determinante da osmolaridade é a capacidade de osmose das membranas celulares, que controlam a passagem de água e solutos entre as células e o meio extracelular. Alterações na permeabilidade das membranas celulares podem afetar a distribuição de água e solutos no organismo, influenciando a osmolaridade das soluções biológicas.
Em resumo, a osmolaridade em um organismo humano é determinada pela concentração de solutos no plasma sanguíneo, pela ingestão de líquidos e alimentos, e pela capacidade de osmose das membranas celulares. O equilíbrio desses fatores é essencial para manter a homeostase do organismo e garantir o funcionamento adequado das células e tecidos.
Osmolaridade: Como Calcular e Diferença com Osmolaridade
A osmolaridade é o parâmetro que mede a concentração de que é de um composto químico em um litro de solução, desde que esta contribui para a propriedade de ligação conhecido como pressão osmótica da referida solução.
Nesse sentido, a pressão osmótica de uma solução refere-se à quantidade de pressão necessária para interromper o processo de osmose, que é definida como a passagem seletiva de partículas de solvente por meio de uma membrana semipermeável ou porosa de uma solução. de menos concentração para mais concentrado.
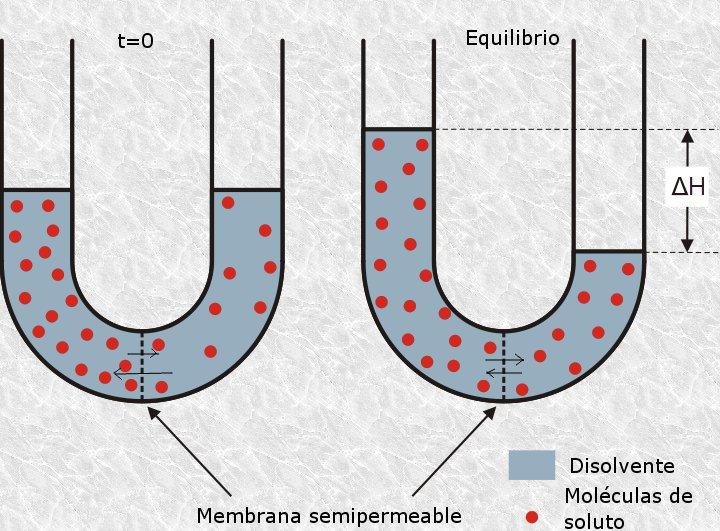
Além disso, a unidade usada para expressar a quantidade de partículas de soluto é o osmol (cujo símbolo é Osm), que não faz parte do Sistema Internacional de Unidades (SI), usado em quase todo o mundo. Portanto, a concentração do soluto na solução é definida em unidades de Osmoles por litro (Osm / l).
Formula
Como mencionado anteriormente, a osmolaridade (também conhecida como concentração osmótica) é expressa em unidades definidas como Osm / l. Isto é devido à sua relação com a determinação da pressão osmótica e a medição da difusão do solvente por osmose.
Na prática, a concentração osmótica pode ser determinada como uma magnitude física com o uso de um osmômetro.
O osmômetro é um instrumento usado para medir a pressão osmótica de uma solução, bem como a determinação de outras propriedades coligativas (como pressão de vapor, aumento do ponto de ebulição ou diminuição do ponto de congelamento) para obter o valor da osmolaridade da solução.
Dessa forma, a fórmula apresentada abaixo é usada para calcular esse parâmetro de medição, que leva em consideração todos os fatores que podem afetar essa propriedade.
Osmolaridade = Σφ i n i c i
Nesta equação, a osmolaridade é estabelecida como a soma resultante da multiplicação de todos os valores obtidos de três parâmetros diferentes, que serão definidos abaixo.
Definição das variáveis na fórmula de osmolaridade
Em primeiro lugar, está o coeficiente osmótico, representado pela letra grega φ (phi), que explica até que ponto a solução se afasta do comportamento ideal ou, em outras palavras, o grau de não idealidade manifestado pelo soluto na solução.
Da maneira mais simples, φ refere-se ao grau de dissociação do soluto, que pode ter um valor entre zero e um, onde o valor máximo que é o da unidade representa uma dissociação de 100%; isto é, absoluto.
Em alguns casos – como sacarose – esse valor excede a unidade; enquanto em outros casos, como o de sais, a influência de interações ou forças eletrostáticas causa um coeficiente osmótico com um valor menor que a unidade, embora ocorra dissociação absoluta.
Por outro lado, o valor de n indica a quantidade de partículas nas quais uma molécula pode ser dissociada. No caso de espécies iônicas, o cloreto de sódio (NaCl), cujo valor de n é igual a dois, é usado como exemplo; enquanto na molécula de glicose não ionizada, o valor de n é igual a um.
Finalmente, o valor de c representa a concentração do soluto, expressa em unidades molares; e o índice i refere-se à identidade de um soluto específico, mas que deve ser o mesmo no momento da multiplicação dos três fatores mencionados acima e, assim, da osmolaridade.
Como calcular?
No caso do composto iônico KBr (conhecido como brometo de potássio), se houver uma solução de concentração igual a 1 mol / l de KBr na água, infere-se que ele possui uma osmolaridade igual a 2 osmol / l.
Isso se deve ao seu forte caráter eletrolítico, que favorece sua completa dissociação em água e permite a liberação de dois íons independentes (K + e Br – ) que possuem uma certa carga elétrica, de modo que cada mole de KBr é equivalente a dois osmoles em solução.
Da mesma forma, para uma solução com uma concentração de 1 mol / l de BaCl 2 (conhecido como cloreto de bário) em água, ele tem uma osmolaridade igual a 3 osmol / l.
Isso ocorre porque três íons independentes são liberados: um íon Ba 2+ e dois íons Cl – . Então, cada mole de BaCl 2 é equivalente a três osmoles em solução.
Por outro lado, espécies não iônicas não experimentam tal dissociação e causam um único osmol por mole de soluto. No caso de uma solução de glicose com uma concentração igual a 1 mol / l, isso equivale a 1 osmol / l da solução.
Diferenças entre osmolaridade e osmolaridade
Um osmol é definido como o número de partículas que são dissolvidas em um volume igual a 22,4 l de solvente, submetidas a uma temperatura de 0 ° C e que causam a geração de uma pressão osmótica igual a 1 atm. Deve-se notar que essas partículas são consideradas osmoticamente ativas.
Nesse sentido, as propriedades conhecidas como osmolaridade e osmolaridade se referem à mesma medida: a concentração de soluto em uma solução ou, em outras palavras, o conteúdo de partículas totais de soluto em solução.
A diferença fundamental que se estabelece entre osmolaridade e osmolaridade está nas unidades em que cada uma é representada:
A osmolaridade é expressa em termos de quantidade de substância por volume de solução (isto é, osmol / L), enquanto a osmolaridade é expressa em quantidade de substância por massa de solvente (isto é, osmol / kg de solução).
Na prática, ambos os parâmetros são usados indiferentemente, mesmo se manifestando em unidades diferentes, devido ao fato de haver uma diferença inestimável entre as magnitudes totais das diferentes medidas.
Referências
- Wikipedia (sf). Concentração osmótica Recuperado de es.wikipedia.org
- Chang, R. (2007). Química, nona edição. México: McGraw-Hill.
- Evans, DH (2008). Regulação Osmótica e Jônica: Células e Animais. Obtido em books.google.co.ve
- Potts, WT e Parry, W. (2016). Regulação Osmótica e Iônica em Animais. Recuperado de books.google.co.ve
- Armitage, K. (2012). Investigações em biologia geral. Obtido em books.google.co.ve