- Isotermico: T costante, p·V costante, Q = W, curva p–V iperbolica.
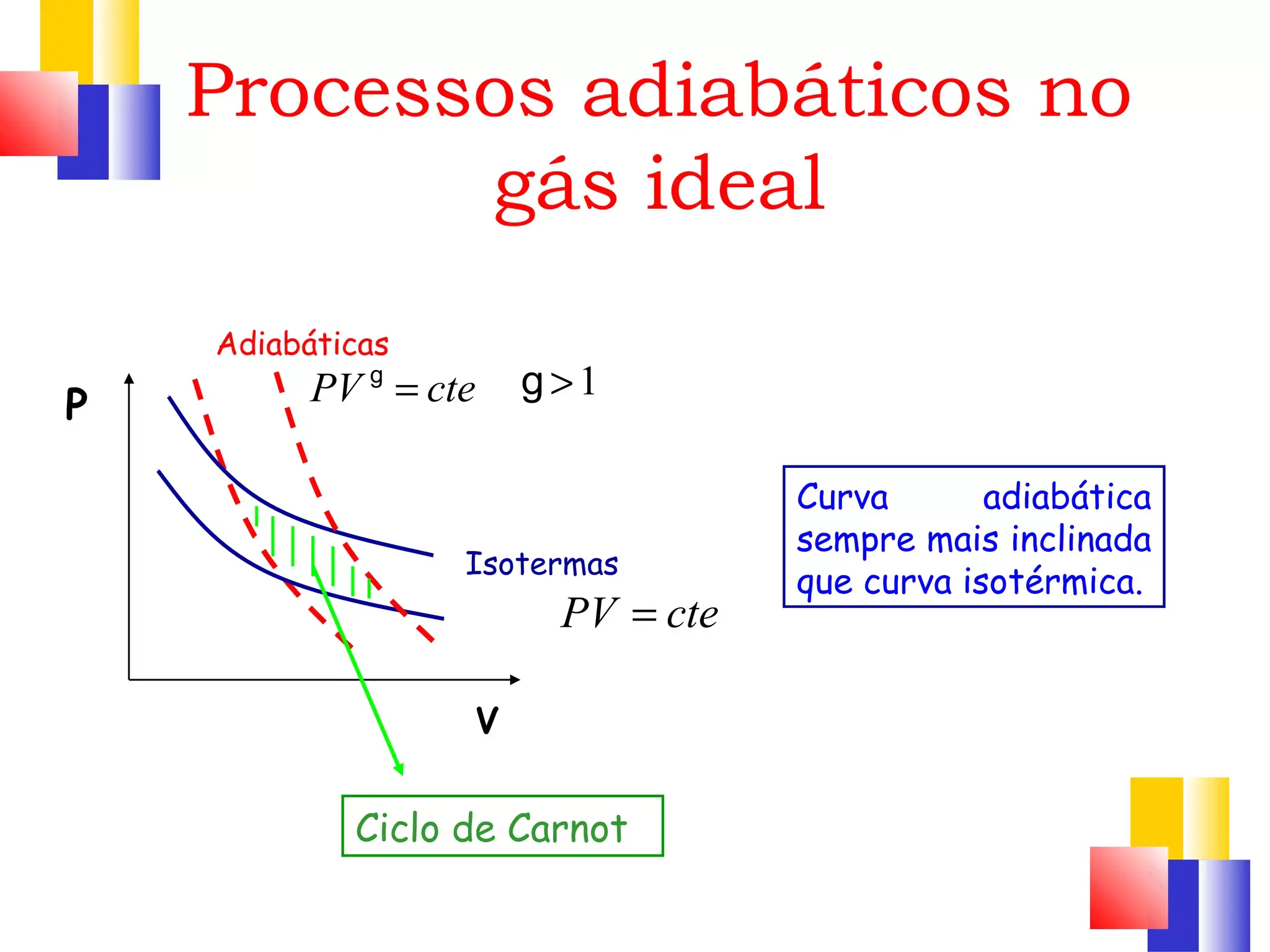
- Adiabatica: Q = 0, p·V^γ costante, ΔT ≠ 0, curva più ripida dell’isotermica.
- Isobarico e isocoro: rispettivamente V/T e p/T costanti; esempi ed esercizi applicativi.
- Formule del lavoro: W = nRT ln(Vf/Vi) (isotermico) e W = (pfVf − piVi)/(γ − 1) (adiabatico).
Quando si parla di processi termodinamici nei gas, si entra in un mondo in cui pressione, volume e temperatura danzano in equilibrio secondo precise leggi fisiche. Capire come e perché queste grandezze variano o restano costanti è fondamentale per interpretare fenomeni quotidiani, dall’uso di una bomboletta spray alla dilatazione di un palloncino dentro un frigorifero.
In questa guida completa troverai una spiegazione chiara e rigorosa dei processi isotermico, isobarico, isocoro/isovolumetrico e adiabatico, con leggi, formule, esempi pratici e alcuni esercizi svolti. Ci soffermeremo anche su un dubbio molto comune: se in un processo isotermico la temperatura non cambia, perché il calore scambiato non è necessariamente zero?
Che cosa si intende per trasformazioni termodinamiche dei gas
Una trasformazione (o processo) termodinamica è un’evoluzione in cui un gas vede modificarsi una o più grandezze di stato: pressione (p), volume (V) e temperatura (T). In alcuni casi una di queste grandezze resta costante, caratterizzando processi speciali molto studiati in fisica e chimica dei gas.
Le trasformazioni più importanti sono quattro: isobarica (p costante), isotermica (T costante), isocora/isovolumetrica (V costante) e adiabatica (nessuno scambio di calore con l’ambiente, cioè Q = 0). Queste tipologie costituiscono la base per analizzare motori termici, apparecchi in pressione e moltissimi fenomeni naturali.
Nel quadro dei gas ideali, ogni trasformazione è descritta da leggi sperimentali classiche e da relazioni energetiche che discendono dalla prima legge della termodinamica. Tale legge stabilisce che la variazione di energia interna ΔU è pari al calore assorbito meno il lavoro compiuto: ΔU = Q − W, un bilancio energetico tanto semplice quanto potente.
Per orientarsi, è utile ricordare che nei gas ideali l’energia interna dipende solo dalla temperatura: se ΔT = 0, allora anche ΔU = 0; se invece la temperatura cambia, cambia pure l’energia interna del gas. Questa proprietà sarà decisiva per distinguere con precisione i processi isotermici da quelli adiabatici.
Trasformazione isotermica
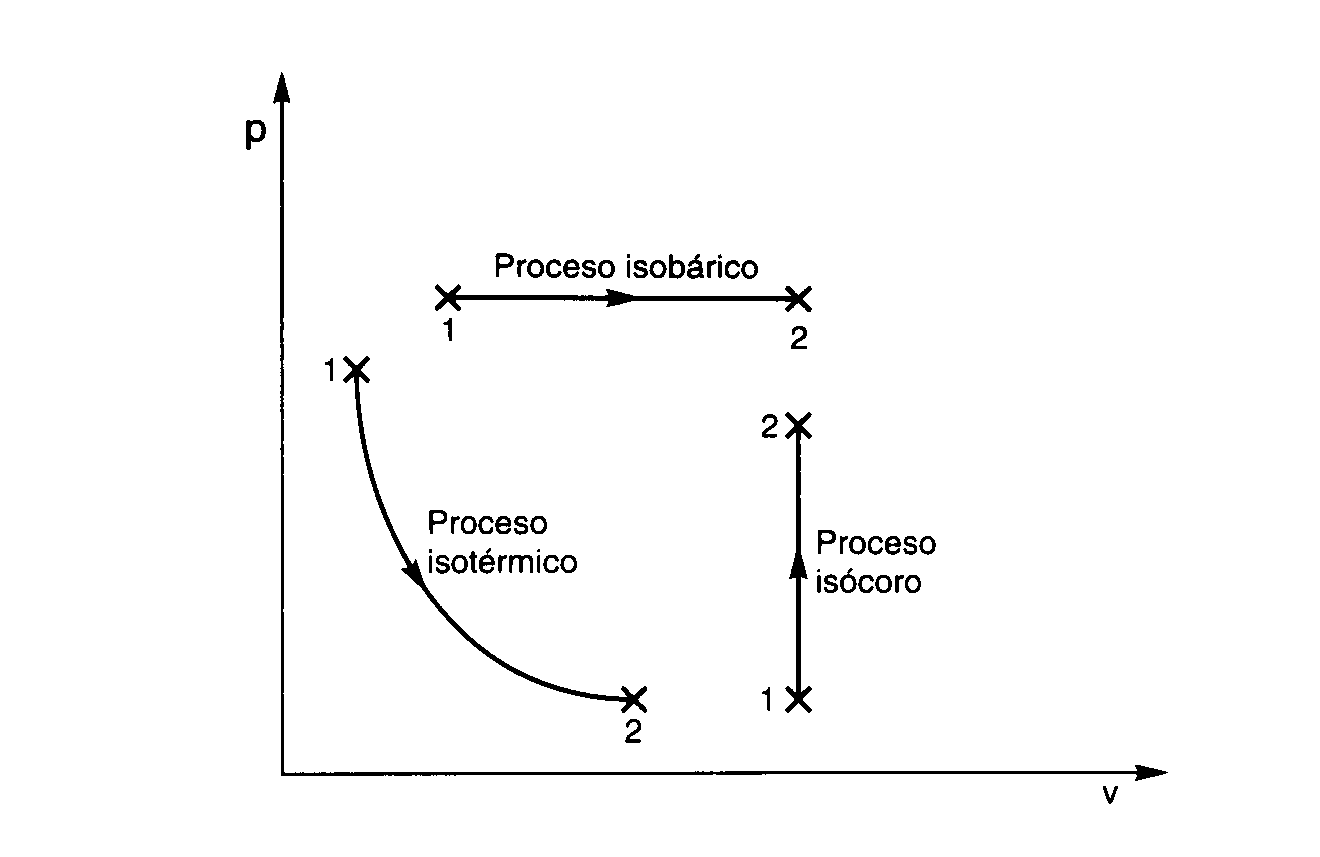
Un processo è isotermico quando la temperatura del gas resta costante lungo tutta la trasformazione. In queste condizioni, per un gas ideale vale la celebre legge di Boyle–Mariotte: il prodotto p·V è costante. In forma iniziale-finale possiamo scrivere piVi = pfVf, evidenziando che pressione e volume sono inversamente proporzionali.
Dal punto di vista energetico, poiché l’energia interna di un gas ideale dipende solo dalla temperatura, mantenere T costante implica ΔU = 0. Di conseguenza, per la prima legge vale Q = W: il calore scambiato con l’esterno e il lavoro sono uguali in modulo e con segno coerente con la convenzione adottata. Questo significa che durante un’espansione isotermica il gas deve assorbire calore per poter compiere lavoro contro l’esterno senza cambiare la sua temperatura.
Il lavoro in un processo isotermico reversibile di un gas ideale si calcola con la formula: W = n R T ln(Vf/Vi). Qui n è il numero di moli, R la costante dei gas e T la temperatura assoluta, che resta invariata. Questa espressione mostra come il lavoro dipenda in modo logaritmico dal rapporto dei volumi iniziale e finale.
Sul piano p–V, la curva isotermica è una iperbole: al crescere del volume la pressione decresce in modo tale da conservare p·V costante. Inoltre, a parità di condizioni iniziali e finali, la curva isotermica è meno ripida rispetto a una corrispondente curva adiabatica, un confronto grafico che tornerà utile più avanti.
Trasformazione isobarica
Una trasformazione isobarica si verifica quando la pressione resta costante durante tutto il processo. In questo caso la legge che lega le grandezze del gas è attribuita a Charles e Gay-Lussac: a pressione costante, il volume è direttamente proporzionale alla temperatura assoluta, cioè V/T = costante e quindi Vi/Ti = Vf/Tf.
In termini fisici, se un gas viene riscaldato a pressione costante, il suo volume aumenta di pari passo con la temperatura; se viene raffreddato, il volume si riduce. Un esempio intuitivo è un palloncino pieno d’aria portato in frigorifero: la pressione esterna rimane quella atmosferica, mentre il gas si raffredda e il volume del palloncino diminuisce.
Nelle trasformazioni isobariche il calore scambiato modifica sia l’energia interna (variando T) sia il lavoro di espansione o compressione, poiché il volume cambia. In notazione differenziale, a p costante, il lavoro elementare è dW = p dV e la variazione di energia interna dipende da ΔT. Si capisce così perché spesso si usano capacità termiche a pressione costante Cp, particolarmente comode quando p non cambia.
Un dettaglio utile: se l’evoluzione è lenta e reversibile, la retta p = costante sul piano p–V diventa il tracciato del processo; in caso contrario, la rappresentazione resta qualitativa, ma la proporzionalità tra V e T continua a fornire una guida affidabile.
Trasformazione isocora (o isovolumetrica)
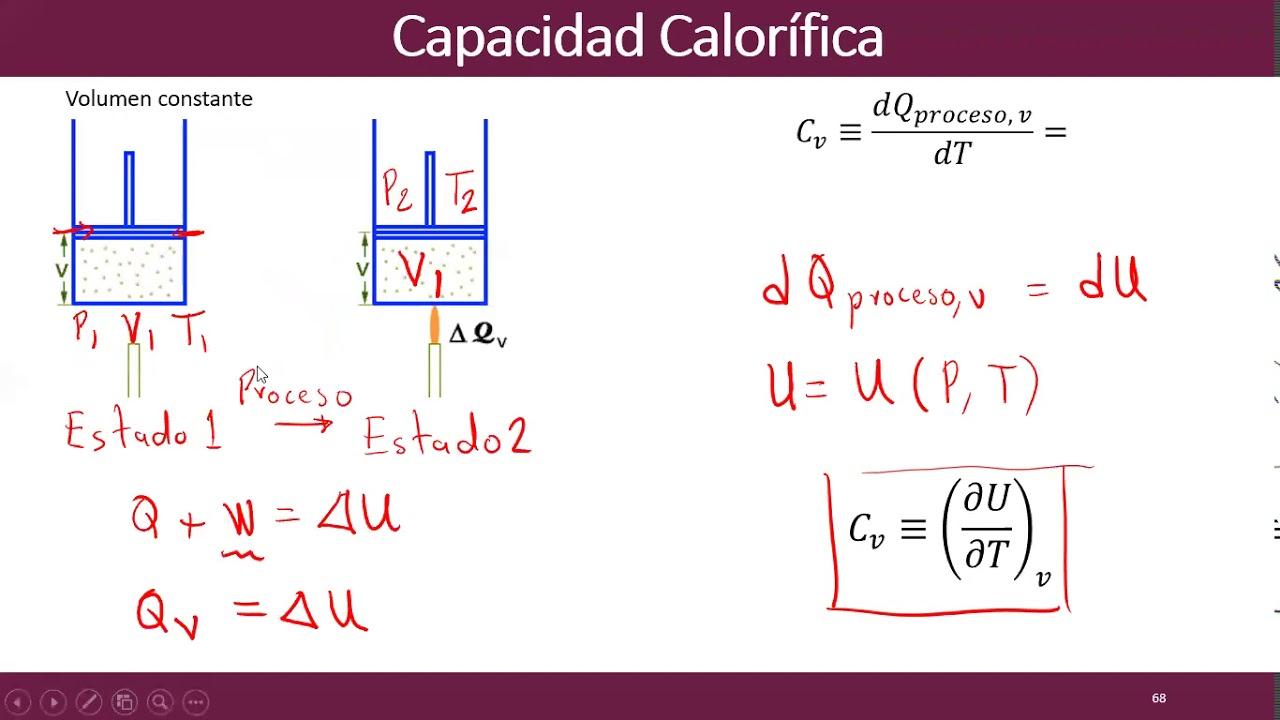
Una trasformazione isocora, detta anche isovolumetrica o isocorica, avviene quando il volume rimane costante. In questa situazione, la legge sperimentale di Charles afferma che la pressione è direttamente proporzionale alla temperatura assoluta: p/T = costante, quindi pi/Ti = pf/Tf.
Poiché V non cambia, il gas non compie lavoro di espansione o compressione (W = 0). Di conseguenza, dalla prima legge segue che l’intero calore scambiato si traduce in variazione di energia interna: Q = ΔU. In un recipiente a pareti rigide, il riscaldamento produce un aumento della temperatura e quindi della pressione del gas.
Un esempio concreto è il riscaldamento del vapore intrappolato in una pentola a pressione perfettamente rigida: finché il volume non può cambiare, la temperatura che sale si riflette in un aumento della pressione interna.
Questa trasformazione è particolarmente utile in laboratorio per collegare in modo diretto variazioni di temperatura e pressione, senza il “disturbo” del lavoro p–V, così da misurare con precisione proprietà termiche dei gas.
Trasformazione adiabatica
Un processo è adiabatico quando non vi è scambio di calore tra sistema e ambiente, cioè Q = 0. Questo può succedere perché il processo è rapidissimo (non c’è tempo materiale per trasferire calore) oppure perché il sistema è isolato termicamente con pareti ben coibentate.
Per un gas ideale in un’adiabatica reversibile vale la relazione p·Vγ = costante, dove γ (gamma) è il rapporto tra le capacità termiche a pressione e volume costanti: γ = Cp/Cv. Questo parametro dipende dai gradi di libertà molecolari del gas: ad esempio per un gas monoatomico γ ≈ 5/3, mentre per uno biatomico a temperatura moderata vale circa 1,4.
Poiché Q = 0, la prima legge si riduce a ΔU = −W. In un’espansione adiabatica il gas compie lavoro a spese della propria energia interna, quindi la temperatura scende; in una compressione adiabatica avviene l’opposto e T aumenta. Questo spiega perché l’adiabatica, a parità di volumi iniziale e finale, risulta più ripida sul piano p–V rispetto all’isotermica.
Il lavoro in un’adiabatica reversibile tra stati iniziale e finale si può esprimere come W = (pfVf − piVi)/(γ − 1). È una formula molto pratica quando si conoscono pressione e volume agli estremi. In alternativa, si può lavorare con le sole temperature usando relazioni equivalenti che sfruttano l’equazione di stato del gas ideale.
Isotermico vs Adiabatico: differenze chiave
Anche se entrambi riguardano l’evoluzione di un gas, i processi isotermico e adiabatico differiscono per aspetti fondamentali, a partire dallo scambio di calore e dal comportamento della temperatura. Confrontarli aiuta a fissare i concetti e a interpretare i diagrammi p–V correttamente.
Scambio di calore: in un isotermico, il sistema scambia calore con l’ambiente per mantenere T costante; in un’adiabatica, per definizione, Q = 0. Questo è il discrimine primario tra i due.
Temperatura: lungo un’isotermica ΔT = 0; in un’adiabatica la temperatura varia, perché l’energia interna cresce o diminuisce in funzione del lavoro scambiato. L’isotermica è quindi “temperatura fissa”, l’adiabatica è “calore nullo”.
Lavoro: per un gas ideale, nell’isotermica reversibile il lavoro è W = n R T ln(Vf/Vi); nell’adiabatica reversibile vale W = (pfVf − piVi)/(γ − 1). In generale, a parità di stati iniziale e finale, il lavoro isotermico e quello adiabitico non coincidono.
Grafico p–V: l’isotermica è una curva iperbolica; l’adiabatica, passando per gli stessi punti estremi, è più inclinata (più ripida), perché non c’è apporto di calore a “sostenere” la pressione durante l’espansione o a “smaltirlo” durante la compressione.
Perché in un isotermico ΔT = 0 ma il calore non è zero?
Questo è uno dei dubbi più frequenti, spesso legato all’uso ingenuo della formula q = m c ΔT. Quell’espressione descrive il calore scambiato in un processo di riscaldamento o raffreddamento di un corpo a capacità termica efficace c nota, in assenza di lavoro meccanico o di altri contributi energetici significativi. Non è una legge universale valida per qualunque trasformazione di un gas che svolge lavoro p–V.
Per i gas ideali bisogna partire dalla prima legge della termodinamica: ΔU = Q − W. In un processo isotermico, siccome l’energia interna dipende solo dalla temperatura, vale ΔU = 0. Allora risulta immediatamente Q = W: pur avendo ΔT = 0, c’è scambio di calore non nullo, necessario a “rifornire” o “smaltire” l’energia che il gas usa per compiere lavoro o che riceve da un lavoro esterno.
Al contrario, in un processo adiabatico Q = 0, ma questo non costringe affatto ΔT a essere zero, anzi: vale ΔU = −W, quindi se il gas compie lavoro a spese dell’energia interna la temperatura diminuisce, mentre se subisce lavoro esterno la temperatura aumenta. Questa differenza concettuale è il cuore del contrasto tra isotermico e adiabatico.
Il messaggio da portare a casa è che la formula q = m c ΔT è un modello utile in scenari semplici, ma per i processi termodinamici dei gas che compiono lavoro p–V è la prima legge (insieme alle proprietà del gas ideale) a guidare l’analisi in modo corretto.
Esempi pratici di trasformazioni
Isotermica: ogni espansione o compressione lenta e ben controllata, in cui il gas resta in contatto termico con un termostato, mantenendo la temperatura costante. È il caso paradigmatico di processi quasi-statici ben regolati in laboratorio.
Isobarica: il raffreddamento dell’aria contenuta in un palloncino posto in frigorifero, dove la pressione esterna (atmosferica) rimane pressappoco costante e il volume si contrae mentre la temperatura scende.
Isocora: riscaldare il vapore d’acqua confinato in un recipiente a pareti rigide, come una pentola a pressione idealmente non deformabile: fissato il volume, l’aumento di temperatura provoca un aumento della pressione.
Adiabatica: la rapida fuoriuscita del gas da uno spray aerosol; il processo è così veloce che lo scambio di calore con l’ambiente è trascurabile, la temperatura del gas diminuisce e spesso si avverte il raffreddamento della bomboletta.
Le tre leggi classiche delle trasformazioni dei gas
Questi processi speciali sono riassunti da tre leggi sperimentali fondamentali. Tutte assumono comportamento ideale del gas e sono limiti di validità molto buoni in ampi intervalli di pressione e temperatura.
Legge di Boyle–Mariotte (isotermica): a temperatura costante, p·V = costante. Ne segue che piVi = pfVf, con p e V inversamente proporzionali. È la base che spiega la forma iperbolica dell’isotermica su un diagramma p–V.
Legge di Gay-Lussac (isobarica): a pressione costante, V/T = costante. In forma iniziale-finale: Vi/Ti = Vf/Tf. Mostra la proporzionalità diretta tra volume e temperatura assoluta.
Legge di Charles (isocora): a volume costante, p/T = costante. Equivalentemente, pi/Ti = pf/Tf. La pressione cresce al crescere della temperatura quando il volume è bloccato.
Esercizi svolti e commentati
Quesito 1. Valuta le affermazioni e indica l’opzione con sole proposizioni vere: I) le trasformazioni isotermiche mantengono costante la temperatura del gas; II) le trasformazioni adiabatiche comportano scambio di calore con l’esterno; III) la trasformazione isocora mantiene costante la pressione; IV) le trasformazioni isobariche avvengono a pressione costante. La chiave sta nell’identificare le definizioni corrette e quelle fuorvianti.
Soluzione: sono vere la I e la IV, poiché isotermico significa T costante e isobarico significa p costante. La II è falsa perché in un’adiabatica Q = 0. La III è falsa: in un’isocora resta costante il volume, non la pressione. L’opzione corretta è dunque quella che riporta I e IV.
Quesito 2. Un gas ideale subisce una trasformazione molto rapida, con variazioni brusche di temperatura, pressione e volume in un intervallo di tempo breve. Qual è la migliore classificazione del processo? Questo è un tipico indizio legato allo scambio di calore trascurabile.
Soluzione: quando l’evoluzione è sufficientemente veloce da impedire il trasferimento di calore con l’esterno, si tratta di un processo adiabatico. In queste condizioni si osservano spesso variazioni nette di p, V e T, proprio perché Q ≈ 0.
Esercizio 3. Trasformazione isobarica: un gas ha volume iniziale V0 = 50 L, temperatura T0 = 270 K e pressione p costante. Dopo il processo il volume vale V = 150 L. A quanto ammonta la temperatura finale T? Qui basta applicare la legge V/T = costante.
Soluzione: V0/T0 = V/T ⇒ 50/270 = 150/T. Da cui 50·T = 150·270 e T = 810 K. L’aumento del volume a pressione costante richiede un aumento proporzionale della temperatura assoluta.
Esercizio 4. Verifica concettuale: I) in un’isocora il volume rimane costante; II) in un’isobarica la pressione rimane costante; III) in un’isotermica la temperatura rimane costante; IV) in un’adiabatica variano volume, pressione e temperatura. Quale opzione afferma correttamente tutte le proposizioni?
Soluzione: in questo insieme, tutte le frasi sono corrette: la IV non contraddice la definizione di adiabatico (Q = 0), perché non impone costanza di p, V o T. Dunque l’opzione giusta è quella che comprende I, II, III e IV.
Approfondimenti utili su γ e sui gradi di libertà
La costante γ = Cp/Cv dipende dalla struttura microscopica del gas, cioè dai gradi di libertà disponibili alle molecole. Un gas monoatomico possiede tre gradi di libertà traslazionali e porta a γ = 5/3; un gas biatomico a temperatura moderata ha ulteriori gradi di libertà rotazionali e di solito γ ≈ 1,4. All’aumentare della temperatura si attivano anche vibrazioni molecolari, che possono modificare i valori effettivi delle capacità termiche.
Questa dipendenza spiega, tra l’altro, perché a parità di condizioni iniziali un’adiabatica con γ maggiore risulta più ripida sul piano p–V, e perché il lavoro e la variazione di temperatura in compressioni/espansioni adiabatiche dipendono dalla natura del gas. Nei calcoli ingegneristici è cruciale scegliere un γ coerente con il regime termico considerato.
Consigli per lo studio e letture collegate
Per consolidare i concetti, è utile tracciare a mano diagrammi p–V che confrontino la stessa coppia di stati iniziale/finale con curve isotermiche e adiabatiche: si vede immediatamente come l’adiabatica sia più ripida e come l’area sottesa (lavoro) cambi con il percorso. Questo esercizio visivo rafforza intuizioni preziose.
Vale la pena inoltre ripassare i principi di termologia (calore, temperatura, capacità termiche) e i fondamenti di termodinamica (lavoro, energia interna, cicli), perché le trasformazioni dei gas si collocano proprio all’incrocio tra questi argomenti. Una volta padroneggiate le basi, formule e leggi diventano strumenti naturali anziché ostacoli.
I processi isotermici mantengono T costante e richiedono scambio di calore per bilanciare il lavoro; nelle trasformazioni adiabatiche il calore non fluisce, quindi è la temperatura a variare per assorbire o fornire l’energia legata al lavoro; isobariche e isocore completano il quadro con relazioni semplici e potenti (V/T costante e p/T costante). Con esempi concreti ed esercizi mirati, l’apparente complessità si trasforma in una mappa chiara e maneggevole.