- Le basi azotate (A, T, G, C e U) definiscono struttura e funzione di DNA e RNA
- Appaiamenti A–T e G–C (A–U nell’RNA) garantiscono complementarità e fedeltà
- Replicazione semiconservativa, trascrizione e traduzione trasformano l’informazione in proteine
- Impatto clinico: diagnostica molecolare, terapie a base di acidi nucleici e medicina di precisione
Se c’è un quartetto che ogni studente di scienze impara a memoria, è quello formato da adenina, timina, guanina e citosina. Queste basi azotate costituiscono il linguaggio chimico con cui la vita scrive, conserva e interpreta le istruzioni biologiche, sia nel DNA sia (con la sostituzione della timina con l’uracile) nell’RNA.
Per capirne definizione e funzioni bisogna fare un giro completo tra acidi nucleici, nucleotidi, legami, regole di appaiamento e processi come replicazione, trascrizione e traduzione. Non solo: le basi azotate sono anche protagoniste di diagnosi molecolari, terapie geniche e medicina personalizzata, perché la sequenza delle basi porta l’informazione genetica e ne regola l’espressione.
Acidi nucleici: che cosa sono e perché contano
Gli acidi nucleici sono macromolecole polimeriche composte da tante unità ripetute (i nucleotidi). Ne esistono due tipi: acido desossiribonucleico (DNA) e acido ribonucleico (RNA). Il DNA immagazzina e trasmette l’informazione genetica, mentre l’RNA la traduce in azione, cioè in sintesi proteica, e in molti casi la modula e la catalizza.
Alcune molecole di RNA possiedono attività enzimatica e sono chiamate ribozimi; questo dettaglio fa capire che gli acidi nucleici non servono solo a codificare, ma anche a catalizzare e regolare. In pratica, archivio (DNA) e officina (RNA) sono due facce della stessa medaglia biologica.
Dal nucleotide al polimero: struttura di base
Il mattone fondamentale è il nucleotide, formato da tre componenti: un gruppo fosfato, uno zucchero pentoso e una base azotata. La pentose è la desossiribosio nel DNA e la ribosio nell’RNA; la differenza chiave è che la desossiribosio ha un atomo di ossigeno in meno rispetto alla ribosio, fatto che incide su stabilità e reattività delle due molecole.
I nucleotidi si collegano tra loro con legami fosfodiestere, in cui il fosfato congiunge il carbonio 3′ di uno zucchero al carbonio 5′ dello zucchero successivo. Questo crea un scheletro zucchero-fosfato su cui sporgono le basi azotate. Le estremità libere della catena sono distinte: a un capo c’è il gruppo fosfato legato al 5′, all’altro un gruppo ossidrilico sul 3′.
Questa direzionalità (5′ → 3′) è fondamentale perché le polimerasi lavorano in un verso specifico e perché l’organizzazione antiparallela delle due catene nel DNA dipende proprio da come i nucleotidi si attaccano lungo la spina dorsale del polimero.
Basi azotate: purine e pirimidine
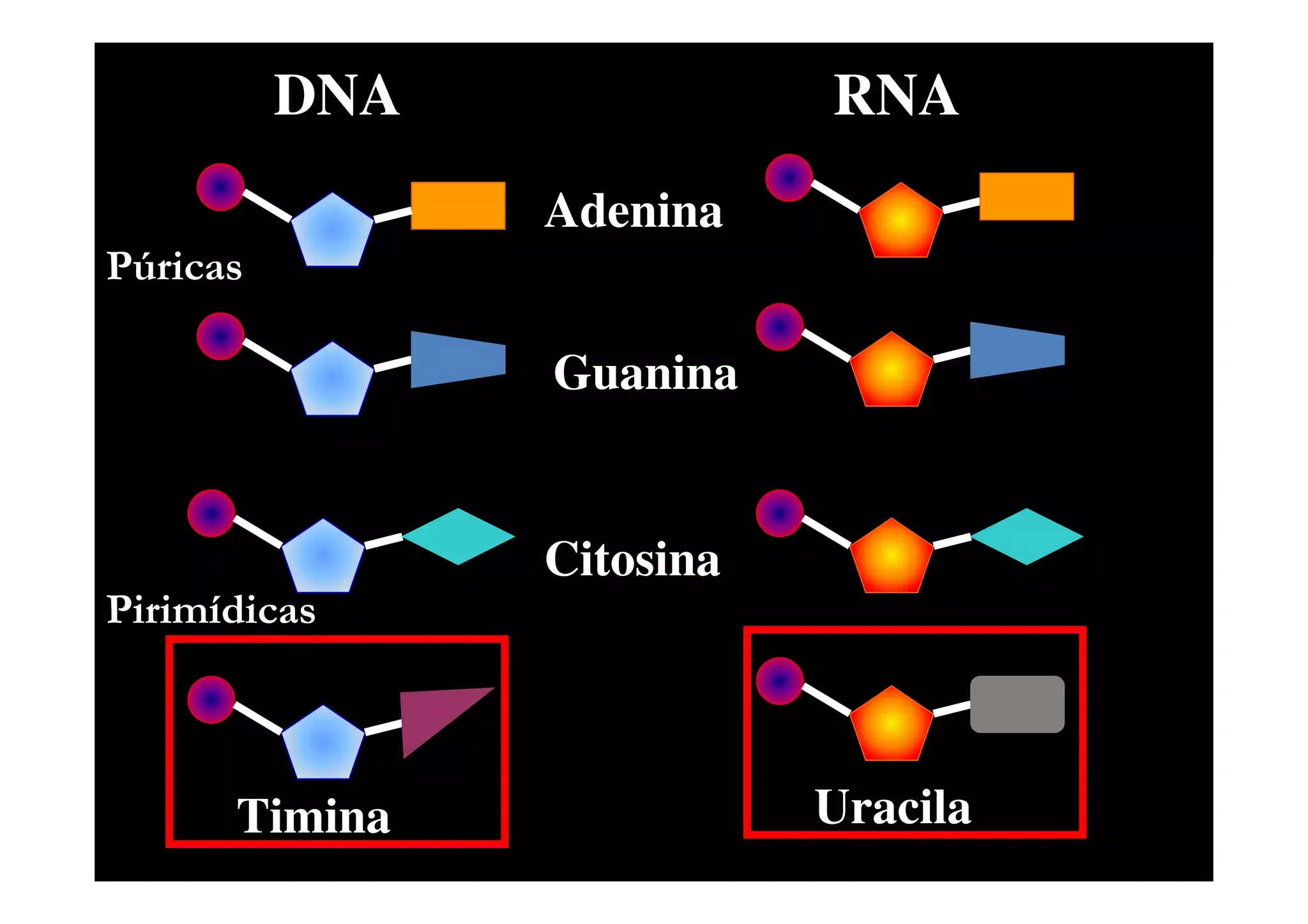
Le basi azotate più comuni negli acidi nucleici sono cinque: adenina (A), guanina (G), citosina (C), timina (T) e uracile (U). Adenina e guanina sono purine (due anelli condensati), mentre citosina, timina e uracile sono pirimidine (un solo anello).
Nel DNA si trovano A, T, G e C; nell’RNA l’uracile prende il posto della timina, per cui le basi sono A, U, G e C. Questa sostituzione, insieme alla presenza della ribosio, rende l’RNA in media più reattivo e meno stabile del DNA, ma anche più versatile nelle sue forme strutturali.
DNA: struttura a doppia elica e appaiamento delle basi
Il DNA è famoso per la sua doppia elica, il modello descritto nel 1953 da James Watson e Francis Crick, reso possibile dai dati di composizione delle basi (Erwin Chargaff) e dalla diffrazione a raggi X (Rosalind Franklin). Le due catene polinucleotidiche si avvolgono attorno a un asse immaginario, con lo scheletro zucchero-fosfato all’esterno e le basi verso l’interno.
Le basi si appaiano in modo complementare e specifico tramite legami a idrogeno: A con T e G con C. L’appaiamento A–T comporta in genere due legami a idrogeno, mentre G–C ne forma tre, contribuendo a una maggiore stabilità delle regioni ricche in G–C.
Poiché le catene scorrono in versi opposti (una 5′ → 3′ e l’altra 3′ → 5′), si definiscono antiparallele. Questo assetto garantisce la complementarità: conosciuta la sequenza di una catena, è possibile ricostruire senza ambiguità la sequenza dell’altra, dettaglio cruciale per replicazione e riparazione.
Un esempio pratico: se un filamento presenta la sequenza AATGCTCC, il complementare sarà TTACGAGG. Allo stesso modo, per 5′-ACCGTCCA-3′ il partner sarà 3′-TGGCAGGT-5′. Questi esempi rendono evidente che quantità di A = quantità di T e quantità di G = quantità di C.
Nelle cellule eucariotiche, il DNA è localizzato nel nucleo, circondato dalla membrana nucleare, ma anche nei mitocondri e nei cloroplasti. Nei procarioti si trova nel nucleoide, una regione non delimitata da membrana. Le molecole di DNA possono essere estremamente lunghe, tra le più grandi macromolecole cellulari.
Le regole di Chargaff spiegate bene
Le osservazioni di Erwin Chargaff possono riassumersi così: in ogni DNA naturale, A ≈ T e G ≈ C, quindi la somma delle purine (A+G) eguaglia quella delle pirimidine (T+C). Non è però richiesto che (A+T) sia uguale a (G+C), infatti (A+T) ≠ (G+C) in molte specie, variando con il contenuto GC del genoma.
Queste relazioni non sono mere curiosità: sono la base quantitativa che rende plausibile il modello a doppia elica e spiegano perché la complementarità risulti necessaria e sufficiente a conservare fedelmente l’informazione durante la replicazione del DNA.
RNA: struttura, appaiamenti e varietà funzionale
L’RNA è tipicamente una singola catena polinucleotidica. Tuttavia, grazie ad appaiamenti intramolecolari tra basi complementari, può ripiegarsi in strutture tridimensionali complesse (gambi, anse, pseudonodi) essenziali per funzioni catalitiche e regolatorie.
Le regole di appaiamento nell’RNA prevedono che adenina si appai con uracile (A–U) e guanina con citosina (G–C). Anche nell’RNA il pentoso è la ribosio, e la presenza dell’ossidrile 2’–OH conferisce maggiore flessibilità chimica, ma riduce la stabilità rispetto al DNA.
Tra le forme funzionali, il mRNA porta l’informazione dai geni ai ribosomi, il rRNA costituisce l’architettura dei ribosomi e catalizza il legame peptidico, il tRNA trasferisce gli amminoacidi durante la traduzione e vari ncRNA (RNA non codificanti) regolano espressione genica, impacchettamento della cromatina e processi post-trascrizionali.
Non va dimenticato che alcuni RNA possiedono attività catalitica (ribozimi), dimostrando che le molecole di acidi nucleici possono agire anche come enzimi in determinati contesti biologici.
Funzioni principali degli acidi nucleici
Il DNA ha come missione primaria archiviare l’informazione ereditaria. I segmenti funzionali di DNA sono i geni, unità ereditabili che guidano lo sviluppo e il funzionamento dell’organismo.
L’RNA, sulla base delle istruzioni del DNA, permette la traduzione dell’informazione in proteine, molecole operative che compiono la maggior parte dei compiti cellulari. Ma non solo: vari RNA regolano l’accesso all’informazione, la maturazione dei trascritti e la loro stabilità, coordinando quando e quanto un gene deve essere espresso.
I meccanismi di regolazione dell’espressione includono elementi del DNA come promotori, enhancers e silenziatori, e processi come lo splicing alternativo, che amplia la diversità proteica senza cambiare la sequenza del DNA.
A livello epigenetico, la metilazione delle citosine (soprattutto nei promotori) può silenziare i geni, mentre modifiche delle istoni modulano l’accessibilità della cromatina, collegando struttura e funzione degli acidi nucleici al controllo preciso dell’attività cellulare.
Replicazione del DNA, trascrizione e traduzione
La replicazione è il processo con cui il DNA viene copiato prima della divisione cellulare. È detta semiconservativa: ogni nuova doppia elica contiene un filamento parentale e uno neosintetizzato. Le DNA polimerasi coordinano una sintesi altamente fedele, sebbene possano verificarsi errori (mutazioni) che, entro certi limiti, alimentano la variabilità biologica.
La trascrizione converte l’informazione del DNA in RNA. Il DNA si apre localmente e un filamento funge da stampo; durante questo processo, quando sullo stampo c’è una adenina, nel trascritto viene inserito uracile (non timina). Una volta trascritto, l’RNA può subire modifiche come capping, poliadenilazione e splicing.
La traduzione avviene sui ribosomi: il mRNA viene letto a triplette (codoni), e i tRNA portano gli amminoacidi corrispondenti per costruire la catena polipeptidica. L’accoppiamento codone–anticodone è un altro esempio dell’importanza delle regole di complementarità tra basi.
Legami chimici e direzionalità: dettagli che fanno la differenza
I legami fosfodiestere collegano i nucleotidi in modo specifico: il fosfato unisce il 3′ di una pentose al 5′ della successiva. Questa chimica crea un backbone resistente e ripetitivo (zucchero–fosfato) su cui agiscono enzimi, proteine leganti e complessi di rimodellamento della cromatina.
Le estremità 5′ e 3′ non sono equivalenti: la prima porta tipicamente un fosfato, la seconda un gruppo –OH. Le macchine cellulari riconoscono questa asimmetria per avviare e terminare sintesi, riparazione e maturazione dei filamenti.
Importanza clinica e applicazioni biomediche
Nella pratica clinica, DNA e RNA sono diventati veri e propri strumenti diagnostici e terapeutici. Il sequenziamento e altri test molecolari consentono di identificare mutazioni e varianti che impattano salute e risposta ai farmaci.
Per le malattie genetiche (es. fibrosi cistica, distrofia muscolare di Duchenne, sindrome di Marfan), la diagnosi si basa spesso su analisi mirate o su sequenziamento, con implicazioni concrete per consulenza genetica, pianificazione familiare e gestione precoce del paziente.
In oncologia, alterazioni di oncogeni e geni oncosoppressori (come BRCA1 e BRCA2) guidano rischio e terapia. Tecniche come la biopsia liquida permettono di rilevare DNA tumorale circolante, monitorando in modo non invasivo l’andamento della malattia.
Nelle malattie infettive, la PCR (reazione a catena della polimerasi) ha rivoluzionato la diagnostica. La RT‑PCR è stata centrale durante la pandemia di COVID‑19 per identificare l’RNA del SARS‑CoV‑2, e tecniche analoghe si applicano a HIV, epatiti, influenza e persino a batteri difficili da coltivare come Mycobacterium tuberculosis.
Terapie basate su acidi nucleici
Le terapie innovative sfruttano direttamente gli acidi nucleici. La terapia genica introduce copie funzionali di geni per correggere difetti; gli siRNA (RNA interferenti) spengono selettivamente geni patogeni; le vaccinazioni a mRNA hanno mostrato l’efficacia di istruire il sistema immunitario senza usare il patogeno vivo.
Questi approcci trasformano DNA e RNA da bersagli a agenti terapeutici, aprendo strade a trattamenti sempre più mirati e personalizzati.
Medicina personalizzata e farmacogenomica
Le varianti genetiche influenzano l’efficacia e la sicurezza dei farmaci. Per esempio, polimorfismi nel gene CYP2C19 condizionano l’attivazione del clopidogrel, un antiaggregante cruciale nelle sindromi coronariche. Conoscere il profilo genetico consente di adattare la terapia al singolo paziente.
Questo approccio, noto come medicina di precisione, si fonda sulla lettura delle basi azotate che compongono il nostro DNA e sull’interpretazione fine delle loro variazioni.
Esempi, esercizi mentali e risorse di studio
Per fissare le idee, prova a verificare gli appaiamenti: se hai 5′-GATTACA-3′, il complementare sarà 3′-CTAATGT-5′. Riconosci subito che A corrisponde a T e G a C, e che le due catene scorrono in versi opposti.
Strumenti come una mappa mentale sugli acidi nucleici possono aiutare a collegare rapidamente i concetti chiave (basi, legami, 5’/3′, enzimi). Se stai studiando per esami o prove selettive, cerca piattaforme con videolezioni, quiz, simulazioni e piani di studio per allenarti con costanza e metodo.
Per approfondire, può essere utile ripassare temi come i Tipi di RNA, i Geni come unità dell’ereditarietà, i Test del DNA e quei concetti di biologia che spesso si confondono agli esami: avere chiaro il quadro generale rende più semplice ogni dettaglio.
Dettagli strutturali spesso chiesti a lezione
Ricorda che la doppia elica può essere descritta come una scala a chiocciola in cui i pioli sono le coppie di basi (A–T e G–C) e i corrimani sono le catene zucchero‑fosfato. Questa rappresentazione aiuta a visualizzare come la complementarità generi stabilità e fedeltà.
La stabilità termica aumenta con il contenuto di G–C per via della terza interazione a idrogeno. In laboratorio, questo si riflette nella temperatura di melting dei duplex, parametro importante in PCR e ibridazioni molecolari.
Infine, la sintesi procede sempre aggiungendo nucleotidi all’estremità 3′ del filamento nascente, sfruttando l’energia dei fosfati ad alta energia (es. dNTP) e mantenendo il verso 5′ → 3′ come regola universale per polimerasi e trascrittasi.
Guardando l’insieme, le basi azotate e gli acidi nucleici formano un sistema coerente in cui chimica, struttura e funzione si intrecciano: dallo scheletro zucchero‑fosfato ai legami a idrogeno, dalle regole di Chargaff alla catalisi dei ribozimi, dalla replicazione semiconservativa alla diagnostica PCR, fino alle terapie a RNA e alla farmacogenomica che cambia il modo in cui curiamo le persone.