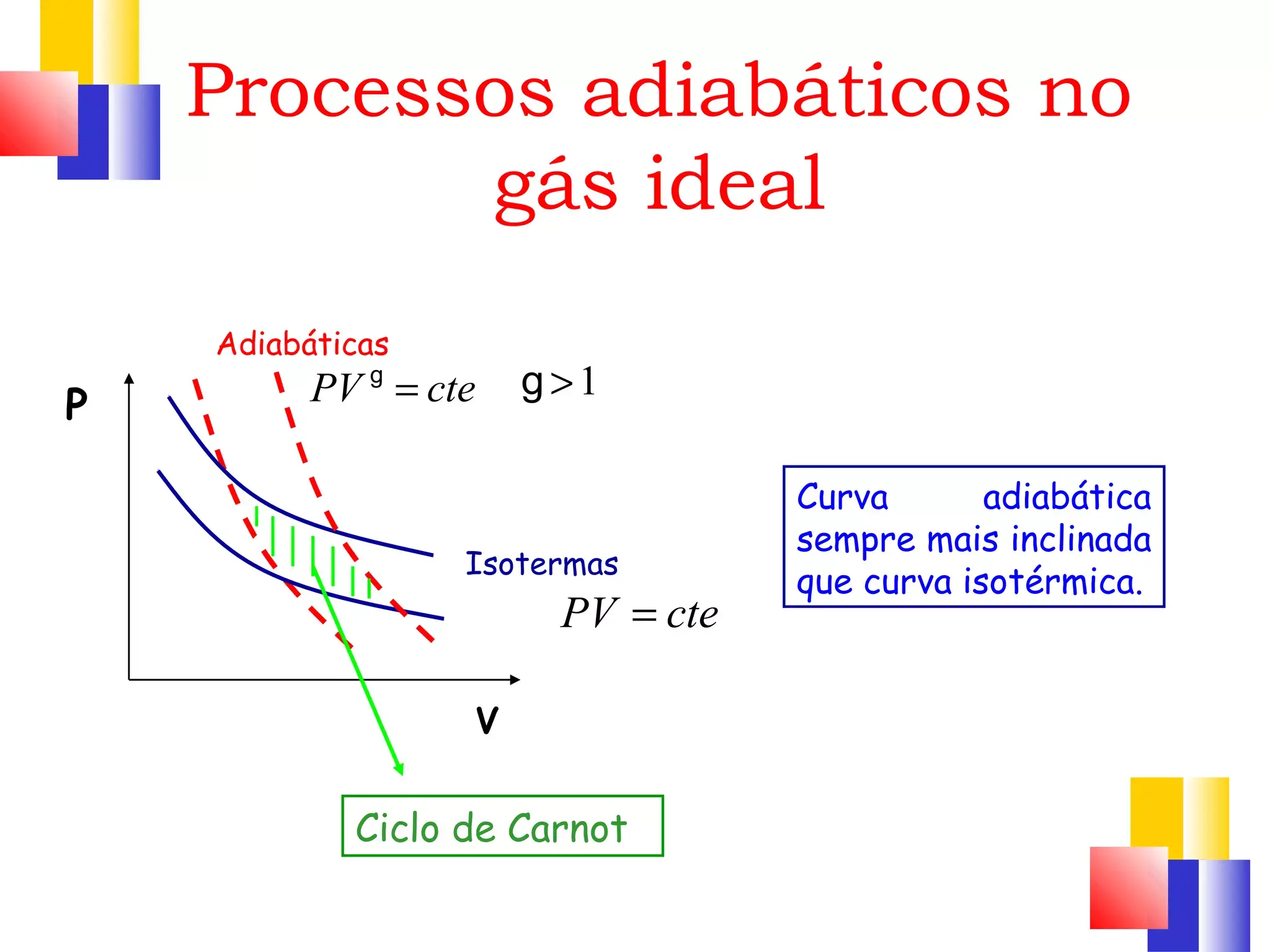
- Isotermico: T costante, pV = costante, ΔU = 0 e Q = W; curva iperbolica su p–V.
- Adiabatico: Q = 0, pV^γ = costante, ΔU = −W; curva più ripida dell’isoterma.
- Isobaro e isocoro: V/T = costante (p fissa) e p/T = costante (V fisso) con esempi pratici chiari.
I processi termodinamici che coinvolgono i gas sono il cuore della fisica del calore: quando un gas cambia pressione, volume o temperatura, diciamo che subisce una trasformazione. Alcune trasformazioni sono “speciali” perché una di queste grandezze resta costante, rendendo la descrizione matematica più pulita e la comprensione concettuale molto più immediata.
Nella pratica incontriamo soprattutto quattro casi: isobaro (pressione costante), isotermico (temperatura costante), isocoro o isovolumetrico (volume costante) e adiabatico (assenza di scambi di calore con l’esterno). Questi scenari, insieme alle leggi dei gas ideali, costituiscono il toolkit per interpretare fenomeni quotidiani e progettare dispositivi come spray, palloncini, pentole a pressione e sistemi termici.
- Isobaro: la pressione rimane costante mentre variano volume e temperatura.
- Isotermico: la temperatura resta invariata e pressione e volume si compensano in modo inverso.
- Isocoro (isovolumetrico): il volume non cambia, a variare sono pressione e temperatura.
- Adiabatico: non si scambia calore con l’ambiente, pur potendo cambiare tutte le grandezze di stato.
Cosa si intende per trasformazioni gassose
Una trasformazione gassosa è un processo termodinamico in cui un campione di gas subisce una modifica del suo stato. In generale, lo stato di un gas ideale è definito da pressione p, volume V e temperatura T; se una di queste grandezze è mantenuta costante, la trasformazione prende un nome specifico e obbedisce a una legge semplice e potente.
Queste leggi sono storiche quanto fondamentali: la legge di Boyle-Mariotte descrive i processi isotermici, la legge di Gay-Lussac i processi isobari, e la legge di Charles i processi isocori. Per i processi adiabatici, che rappresentano il caso senza scambi di calore, entra in gioco il rapporto tra capacità termiche γ = Cp/Cv, collegato ai gradi di libertà microscopici del gas.
Nel linguaggio della termodinamica, queste trasformazioni sono il ponte tra la termologia (studio di calore e temperatura) e la termodinamica (studio dell’energia e delle sue trasformazioni). Capirle significa saper leggere i grafici p–V, applicare correttamente le formule del lavoro e del calore, e smontare equivoci comuni come quello su q = m c ΔT nei processi con lavoro.
Molto spesso, nella realtà, i processi non sono perfettamente ideali. Tuttavia, le trasformazioni speciali forniscono modelli di riferimento per approssimare bene ciò che accade in esperimenti di laboratorio e in molte applicazioni tecnologiche.
Trasformazione isotermica
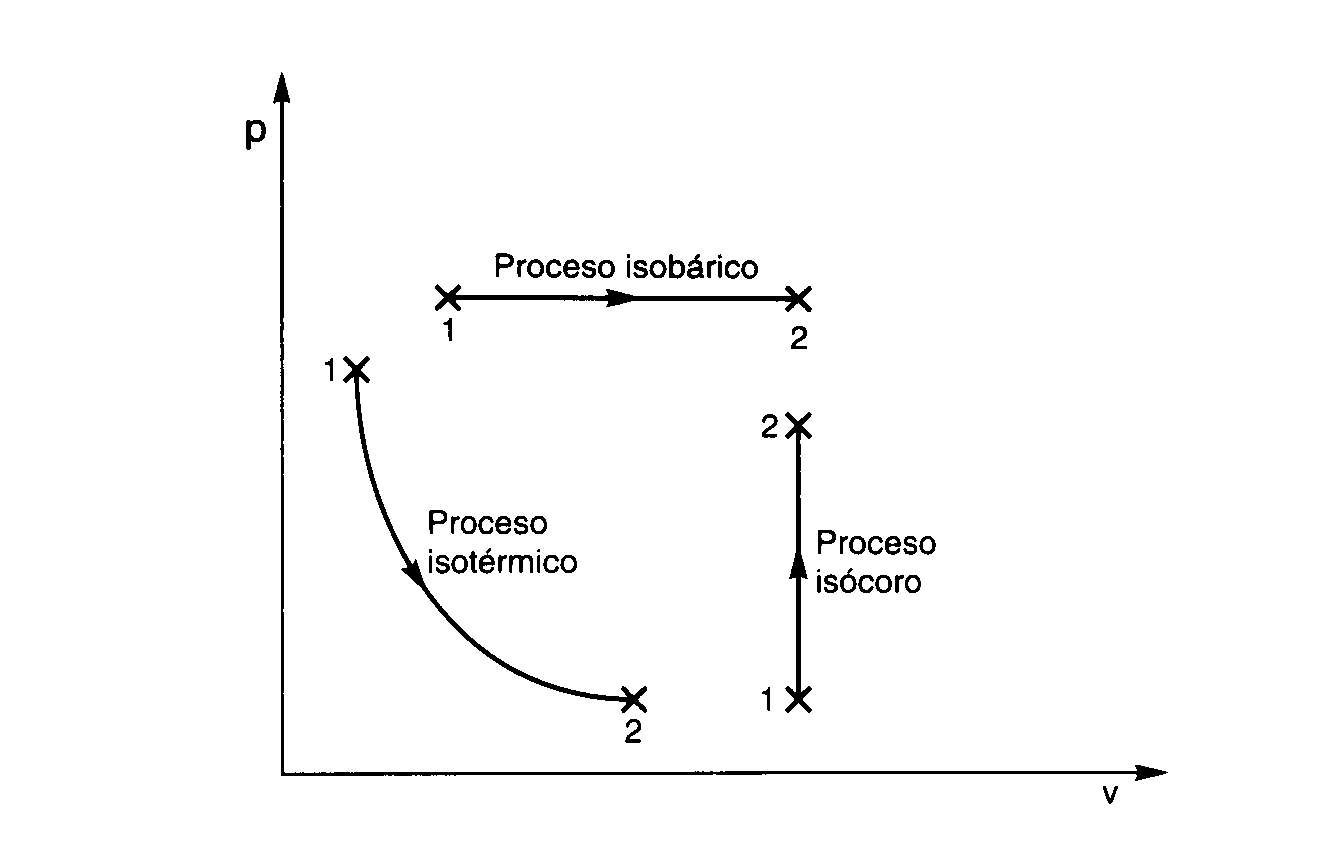
Una trasformazione è detta isotermica quando la temperatura del gas resta costante durante tutto il processo. In queste condizioni, per un gas ideale, pressione e volume sono inversamente proporzionali: se il volume aumenta, la pressione diminuisce in modo tale da mantenere costante il prodotto pV.
La legge che regola l’isotermico è la legge di Boyle-Mariotte: p · V = costante. In forma “iniziale-finale” si scrive comodamente piVi = pfVf, utile per confrontare stati diversi di uno stesso campione a stessa temperatura. Qui vale dare un nome chiaro alle grandezze: pi, pf sono pressioni iniziale e finale; Vi, Vf sono volumi iniziale e finale; la costante dipende dalla temperatura (che è fissa) e dalla quantità di sostanza.
Sul piano p–V l’isoterma appare come una iperbole: la curva tende agli assi senza mai toccarli, segnalando proprio quel prodotto pV invariabile. Non è solo estetica: la forma della curva traduce in grafico l’idea fisica che la temperatura fissa impone una certa “coreografia” a pressione e volume.
Un punto chiave spesso sottovalutato riguarda l’energia interna. Per un gas ideale, l’energia interna dipende soltanto da temperatura, quindi in un isotermico la sua variazione è ΔU = 0. Da qui discende, grazie alla prima legge della termodinamica, che il calore scambiato non è nullo in generale ma è pari al lavoro: Q = W. Il gas assorbe calore dall’esterno mentre si espande lentamente a temperatura fissa e compie lavoro sull’ambiente.
La formula del lavoro isotermico è una delle più utilizzate: W = n R T ln(Vf/Vi). È tanto elegante quanto rivelatrice: il lavoro dipende dal logaritmo del rapporto tra volumi e dalla temperatura (che è costante), oltre che dalla quantità di sostanza n e dalla costante dei gas R.
Un esempio tipico di trasformazione isotermica è una espansione lenta di un gas in contatto con un termostato: la lentezza garantisce il tempo necessario perché il sistema scambi calore e mantenga T costante mentre cambia V (e quindi p).
Trasformazione isobara
Nel processo isobaro la grandezza che resta fissa è la pressione. In questo scenario, volume e temperatura variano in proporzione diretta: se T raddoppia, anche V raddoppia (a parità di quantità di sostanza). È il regno della legge di Gay-Lussac, che si esprime nella forma più pratica come V/T = costante e, tra stati iniziale e finale, Vi/Ti = Vf/Tf.
Questa relazione è intuitiva: mantenere fissa la pressione significa consentire al gas di espandersi o contrarsi per “inseguire” la temperatura. In termini energetici, durante un isobaro si scambia generalmente sia calore sia lavoro, e il legame preciso dipende dai dettagli del processo e dalla capacità termica a pressione costante Cp.
Un esempio quotidiano? Considera un palloncino pieno d’aria che viene messo in frigorifero: la pressione esterna resta all’incirca quella atmosferica, mentre scendendo la temperatura si riduce il volume del gas. Si tratta, con buona approssimazione, di una trasformazione a pressione costante.
Tra gli strumenti da ricordare c’è anche la forma combinata dell’equazione dei gas, utile per transizioni tra stati: pV/T = costante. In isobara, ponendo p costante, resta proprio il rapporto V/T invariato, il che rende immediati i calcoli sui cambiamenti di volume al variare della temperatura.
Trasformazione isocora (isovolumetrica)

Si parla di trasformazione isocora (o isometrica, o isovolumetrica) quando il volume resta costante. In questo caso, a giocare la partita sono pressione e temperatura, che variano in modo direttamente proporzionale secondo la legge di Charles: p/T = costante, dunque pi/Ti = pf/Tf.
Poiché V non cambia, l’interpretazione energetica è pulita: il lavoro di espansione meccanico è nullo (W = 0), perché W dipende dalla variazione di volume. Il calore scambiato, allora, coincide con la variazione di energia interna, strettamente legata alla temperatura: Q = ΔU = n Cv ΔT per un gas ideale.
Un esempio molto noto è il riscaldamento del vapore in una pentola a pressione completamente piena e rigida: il volume è fisso, perciò un aumento di temperatura comporta un aumento proporzionale di pressione, coerente con la legge di Charles.
Nei grafici p–T a volume costante, la relazione lineare è evidente, mentre su p–V si osserva un segmento verticale (poiché V non cambia). Anche qui la linearità racconta un fatto profondo: a fissare V, temperatura e pressione viaggiano insieme.
Trasformazione adiabatica
Una trasformazione è adiabatica quando non c’è scambio di calore con l’ambiente: Q = 0. Attenzione, però: questo non significa che la temperatura non cambi; anzi, durante una compressione rapida, T tende ad aumentare, e durante una espansione rapida tende a diminuire.
Per i gas ideali, l’adiabatica è descritta elegantemente da p · Vγ = costante, dove γ è il rapporto tra capacità termiche Cp e Cv: γ = Cp/Cv. Il valore di γ dipende dai gradi di libertà delle molecole (traslazionali, rotazionali, vibrazionali), quindi anche dalla natura del gas e dall’intervallo di temperatura considerato.
Dal punto di vista energetico, con Q = 0 la prima legge si riduce a ΔU = −W (adottando il segno convenzionale per cui W è il lavoro fatto dal sistema). In pratica, l’energia interna aumenta quando l’ambiente compie lavoro sul gas (compressione) e diminuisce quando il gas compie lavoro sull’ambiente (espansione).
Una formula utile per il lavoro adiabatico tra uno stato iniziale (pi, Vi) e uno finale (pf, Vf) è W = (pfVf − piVi)/(γ − 1). È coerente con l’idea che il lavoro “arrivi” esclusivamente da variazioni di energia interna, non essendoci scambi di calore.
Grafico alla mano, l’adiabatica su p–V è una curva più ripida dell’isoterma corrispondente: per ottenere la stessa variazione di volume, la pressione cala (in espansione) o alza (in compressione) più velocemente rispetto al caso a temperatura costante.
Esempio reale? L’espulsione rapida di gas da una bomboletta aerosol: l’espansione è così veloce che non c’è tempo per scambiare calore con l’ambiente, e il gas si raffredda sensibilmente, dando proprio la sensazione di “freddo” al tocco.
Isotermico e adiabatico a confronto: il chiarimento chiave su q = m c ΔT
Un dubbio comune è questo: se in un isotermico la temperatura non cambia, allora perché il calore scambiato non dovrebbe essere zero, dato che spesso si legge q = m c ΔT? La risposta sta nelle ipotesi dietro quella formula e nella prima legge della termodinamica.
La prima legge dice che Q = ΔU + W (con segni coerenti con la convenzione adottata). Per un gas ideale, l’energia interna dipende solo dalla temperatura, quindi se T non cambia, ΔU = 0. Nel processo isotermico, però, il gas esegue lavoro (ad esempio durante un’espansione): di conseguenza, Q = W e non zero. Serve fornire calore dall’esterno per mantenere la temperatura costante mentre il sistema fa lavoro.
La relazione q = m c ΔT vale come calore sensibile quando il calore fornito o sottratto si traduce interamente in una variazione di temperatura a parità di altre condizioni (nessun lavoro di espansione, o ci si riferisce a calori specifici “a vincolo” come Cp o Cv con un percorso preciso). Nei processi con lavoro, invece, il calore non è obbligato a cambiare T: può andare a compensare il lavoro compiuto, mantenendo la temperatura costante.
Al contrario, in un processo adiabatico il calore scambiato è per definizione Q = 0, ma la temperatura può variare proprio perché entra in gioco il lavoro: ΔU = −W. Nelle compressioni rapide T sale, nelle espansioni rapide T scende. È il motivo per cui, durante variazioni brusche, il comportamento reale assomiglia spesso a un’adiabatica.
Quindi: isotermico significa ΔT = 0 ma Q in genere diverso da zero (bilancia il lavoro); adiabatico significa Q = 0 ma ΔT in genere diverso da zero (bilanciamento tramite lavoro e energia interna).
Grafici p–V: come riconoscere le curve
Sul diagramma pressione-volume, un’isoterma è una iperbole (pV = costante), mentre un’adiabatica è una curva più inclinata che “cade” più rapidamente in espansione. Per l’isobaro, si ha una linea orizzontale (p costante), per l’isocoro una linea verticale (V costante). Questi profili permettono di riconoscere immediatamente il tipo di trasformazione e di confrontarne il lavoro (l’area sottesa alla curva).
Dal confronto isoterma/adiabatica con stesso punto iniziale, l’adiabatica passa al di sotto (in espansione) o al di sopra (in compressione) dell’isoterma: a parità di variazione di volume, la differenza di area riflette differenze nel lavoro e, di conseguenza, nel calore scambiato.
Esempi di trasformazioni gassose
- Isotermica: espansione o compressione lenta del gas con temperatura mantenuta costante da un termostato.
- Isobara: raffreddare un palloncino in frigorifero, con pressione esterna circa costante e volume che diminuisce al calare di T.
- Isocora: riscaldare il vapore in una pentola a pressione completamente piena, con volume fisso e pressione che cresce con la temperatura.
- Adiabatica: gas espulso da uno spray aerosol, con espansione rapida e sostanziale assenza di scambi di calore.
Esercizi svolti e quiz
Quiz 1 – Quali affermazioni sono corrette?
I) Le trasformazioni isotermiche avvengono a temperatura costante. Vero.
II) Le trasformazioni adiabatiche comportano scambio di calore con l’esterno. Falso, in un’adiabatica Q = 0.
III) La trasformazione isocora mantiene costante la pressione. Falso, mantiene costante il volume.
IV) Le trasformazioni isobare avvengono a pressione costante. Vero.
La combinazione corretta è I e IV. Risposta: D.
Quiz 2 – Un gas ideale subisce una trasformazione molto rapida: pressione, volume e temperatura variano bruscamente in poco tempo. Di che processo si tratta?
Le trasformazioni rapide tendono a essere adiabatiche: non c’è tempo per scambiare calore con l’ambiente. Risposta: C.
Esercizio 1 (isobaro) – Un gas passa da V0 = 50 L, T0 = 270 K, p0 = 2 atm a V = 150 L, con pressione costante. Qual è la temperatura finale?
In isobara vale V/T = costante, dunque V0/T0 = V/T. Sostituendo: 50/270 = 150/T. Da cui 50·T = 150·270 → T = 40500/50 = 810 K. Risposta coerente: 810 K.
Esercizio 2 (vero/falso) – I) In isocora, il volume resta costante. II) In isobara, la pressione resta costante. III) In isotermica, la temperatura resta costante. IV) In adiabatica variano volume, pressione e temperatura.
Tutte e quattro le frasi sono vere. Risposta: C.
Leggi dei gas e formule riassuntive
Quando una sola grandezza resta fissa, possiamo sfruttare leggi molto semplici e potenti:
- Isotermico (T costante): pV = costante; tra stati: piVi = pfVf; lavoro: W = n R T ln(Vf/Vi).
- Isobaro (p costante): V/T = costante; tra stati: Vi/Ti = Vf/Tf.
- Isocoro (V costante): p/T = costante; tra stati: pi/Ti = pf/Tf; lavoro: W = 0.
- Adiabatico (Q = 0): pVγ = costante; lavoro: W = (pfVf − piVi)/(γ − 1).
Ricordare l’equazione combinata dei gas pV/T = costante aiuta a muoversi tra stati diversi, sostituendo la grandezza che rimane costante in ciascun caso. È una scorciatoia estremamente utile nei problemi d’esame.
Approfondimenti consigliati
Per consolidare concetti come capacità termiche, energia interna e scambi di calore, è utile ripassare i capitoli di Termodinamica e Termologia, spesso affiancati alla Calorimetria nei corsi di base. Qui di seguito due risorse in pdf per chi desidera andare oltre:
Scarica PDF 1 — trasformazioni e leggi per i gas ideali.
Scarica PDF 2 — processi termodinamici e teoria cinetica.
Quanto visto fin qui mette ordine su cosa cambia e cosa resta costante in ciascuna trasformazione, su quali leggi applicare, su come leggere i grafici p–V e su come trattare correttamente lavoro e calore. Se si tieni a mente che nell’isotermico ΔU = 0 ma Q = W, e che nell’adiabatico Q = 0 ma ΔU = −W, diventa naturale riconoscere le situazioni reali (espansioni lente vs rapide, sistemi isolati vs in contatto termico) e risolvere con sicurezza gli esercizi più tipici.